| |
|
| 知识库 -> 两性话题 -> 肿瘤长什么样?会有很多血管缠绕在周围吗? -> 正文阅读 |
|
|
[两性话题]肿瘤长什么样?会有很多血管缠绕在周围吗? |
| [收藏本文] 【下载本文】 |
|
想看照片 |
|
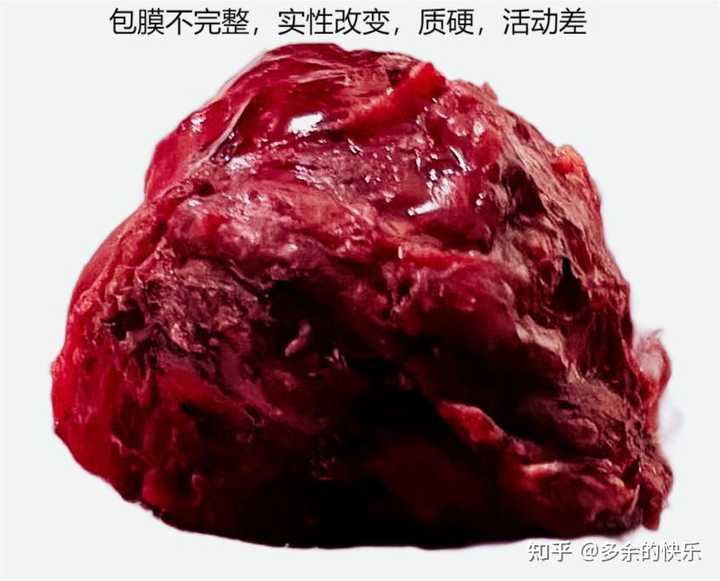
我的胸腺鳞状细胞癌长得很像一块新鲜牛肉,5厘米×5厘米大小,肿瘤没有包膜,里面包裹着膈神经(膈神经据说就像牛筋一样,一拉会有伸缩感),肿瘤侵犯了心包,还粘连了升主动脉,手术时还发现有不明来源血管供血,能把它切下来实属万幸。 |
|
|
胸腺鳞状细胞癌 胸腺癌治疗那些事(三)49 赞同 · 10 评论文章 |
|
|
|
|
完整切除的肝癌病灶 肿瘤位于切除组织的正中央 |

|
|
|

|
|
该图片有可能会引起不适 继续查看 周围都是正常肝组织 但是已经硬化了 好在肿瘤不大,包膜完整,界限清楚 彻底切除以后,还是有治愈的希望的 病人是乙肝携带者 坚持每半年复查一次彩超、甲胎蛋白、肝功能 就是复查彩超发现肝脏低回声占位,甲胎蛋白升高 做了增强核磁 诊断为肝癌 然后立刻做了手术切除 乙肝,是肝癌的高危因素 乙肝携带者尤其是肝硬化病人一定要坚持定期复查,不仅要做彩超,还要定期做增强核磁 才能够早期发现肝癌 然后通过手术切除或者微波消融来获得最好的治疗效果 |

|
|
李医生 1361 次咨询 5.0 医师执业证持证人 121096 次赞同 去咨询 |
|
|
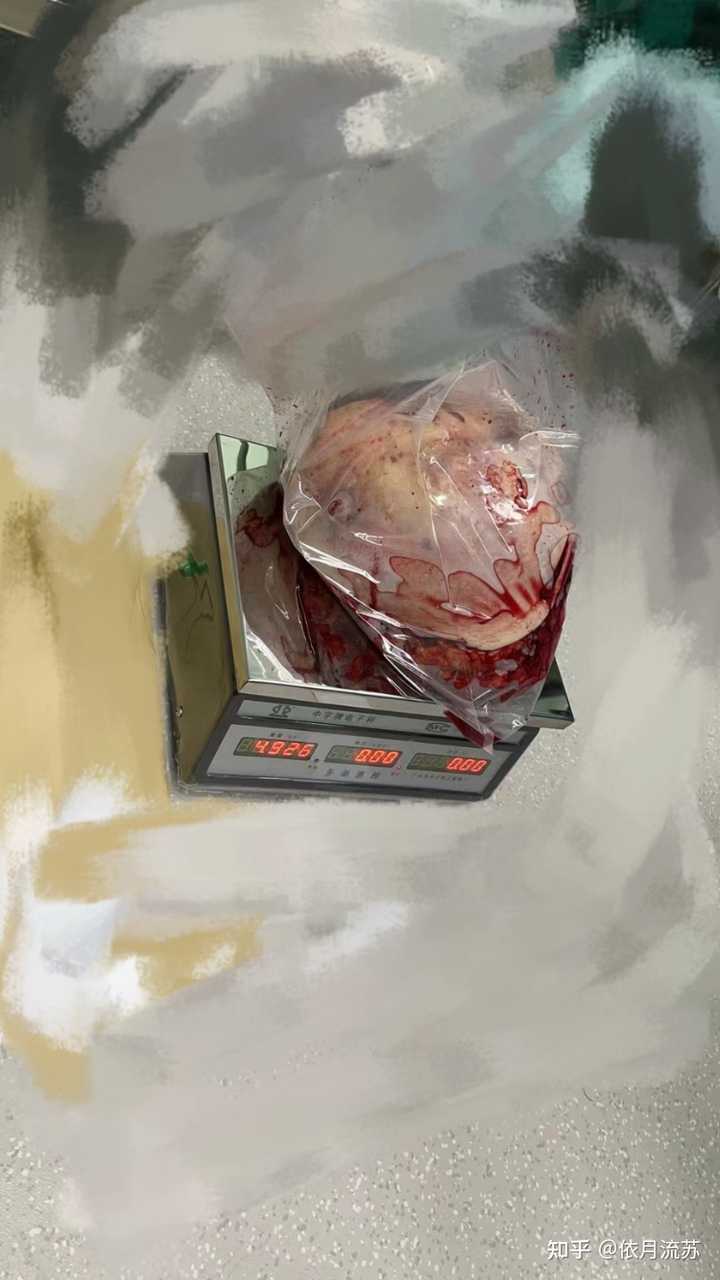
乳房叶状肿瘤,每年都得切几个这玩意儿,小的五六近,大的十来斤,我见过的最大的也就十来斤了,猜测它最大就这么大了,因为也没见同行展示20斤以上的。 手术突出一个备好血,然后就是快准狠的边切边扎,对于不太好操作的大个的,就冷刀真接劈下来再止血。 这么大个东西,滋养血管都是一大堆的,术前影像找到最大的一两支标记那,术中先扎了或者术前介入先堵上,手术时才能减少出血。最少的一次5斤肿瘤出血200cc,最多就是这个大的,出了600cc。可能体表肿瘤还是好搞,不影响大的主干血管,难度也比较低,主要的手术难点还是在巨大缺损的修复上,一般需要做个皮瓣盖一下。 这种东西长这么大,不是自己讳疾忌医就是迷信野生中医不肯手术的,真的,一言难尽。还见过一个修道的,天天在道观,被家人抓住送来医院的。 人类物种多样性了属于。。 ============2月24日更新↓====== |

|
|
这个两斤多,刚切下来。。。这种肿瘤感觉也是越来越多了,所以有发现长得快的结节一定要早点处理。。。 |
|
可能看得有点不清楚 这是我的 上颌窦骨肉瘤2022.1.8手术取出来的。 |

|
|
这是2023.8.24 上颌窦骨肉瘤复查有做了一次手术 |

|
|
|
|
满足一下你,给你看看骨肿瘤的样子。 |
|
|
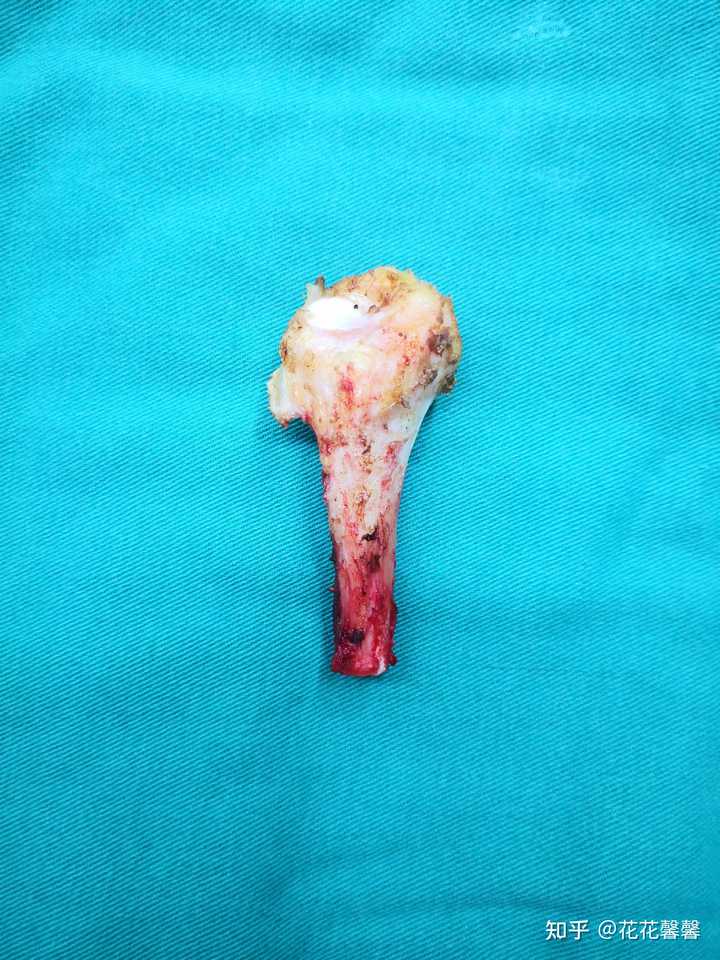
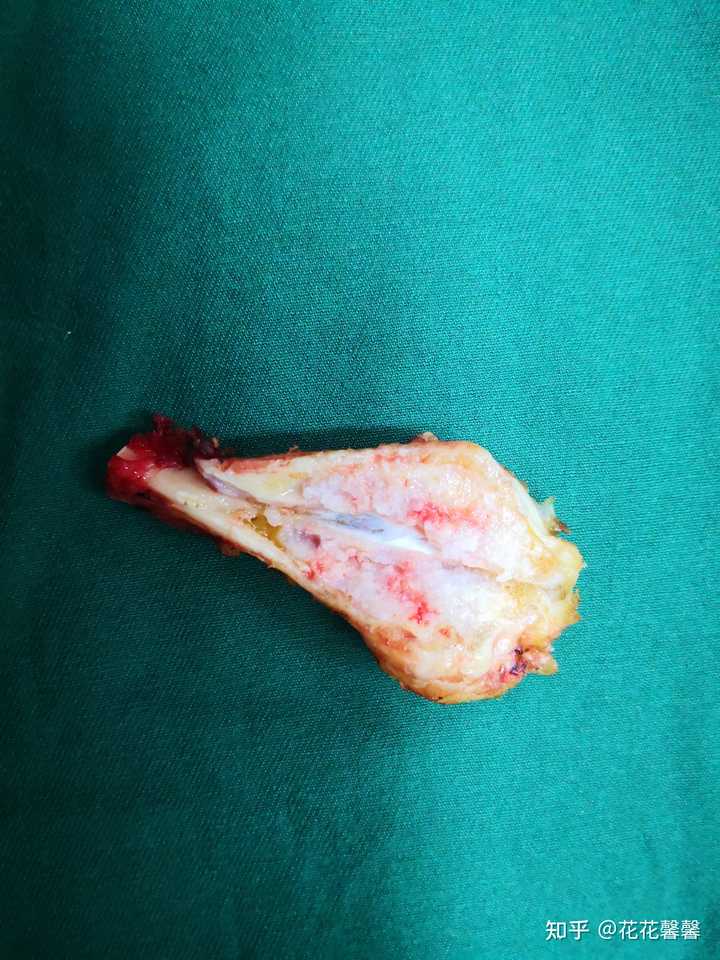
截取的腓骨近端,外观无异常,肿瘤藏在骨头里面 |
|
|
劈开骨头,可见里面白色的肿瘤 袋(左腓骨近端)长骨组织,长6.5cm,一端宽0.7cm,另一端宽2.5cm,已切开,切面可见大小2.2x1.7cm灰白肿物似有缺损,肿物部分质软(1),断端(2),肿物+周围脱钙(3-6)。 这块骨头的故事在这里: 我的腓骨近端软骨肉瘤治疗经历355 赞同 · 113 评论文章 |
|
大体如图这个样子。 |
|
|
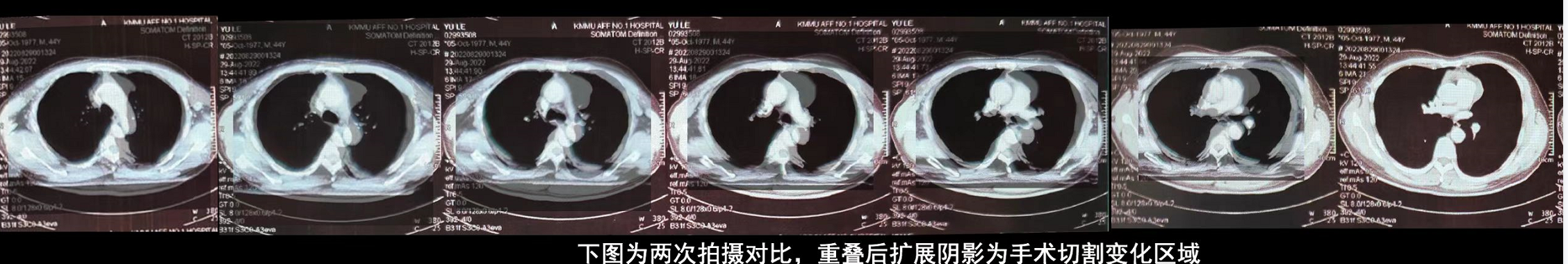
从CT上看如下图 |

|
|
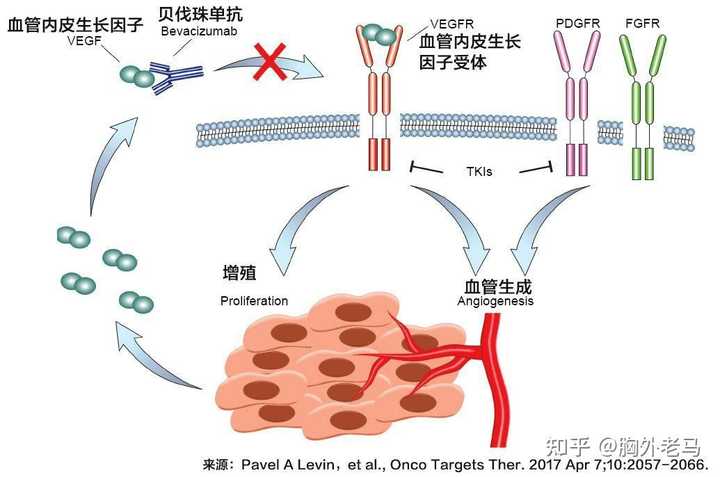
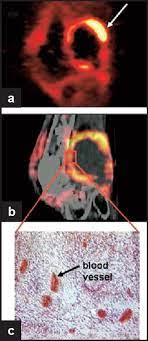
血管集束征是肺癌特征性的表现之一,此时肺癌周围增粗的血管聚集于肿块周围,予以血供和营养支持。从侧面来说肺癌的供血丰富,尤其是见于肺腺癌。 那么我们怎么办呢? 肿瘤周边有很多供应养料的血管。特别多!而且不断新生! 新生血管是组织利用既存血管产生新的血管的过程,是肿瘤生长和转移的重要机制。 肿瘤新生血管的生成过程受血管生成正负调节因子的共同调控,重要的血管生成正调节因子包括纤维生长因子、血管内皮细胞生长因子、血管生成素、血小板衍化生长因子和基质金属蛋白酶等20余种。 血管生成负调节因子包括血管抑素、内皮抑素、血小板反应素和基质金属蛋白酶(MMP)组织抑制剂等20余种。 |
|
|
肿瘤新生血管生成抑制剂即能破坏或者抑制肿瘤的新生血管生成,通过上面两条途径的调节,可以有效地阻止肿瘤生长和转移———把她们饿死! 现在正在应用的比如贝伐单抗、安罗替尼、~…等等很多药物可以起到上述作用。 |

|
|
胸外老马 106 次咨询 5.0 51211 次赞同 去咨询 |

|
|
|
|
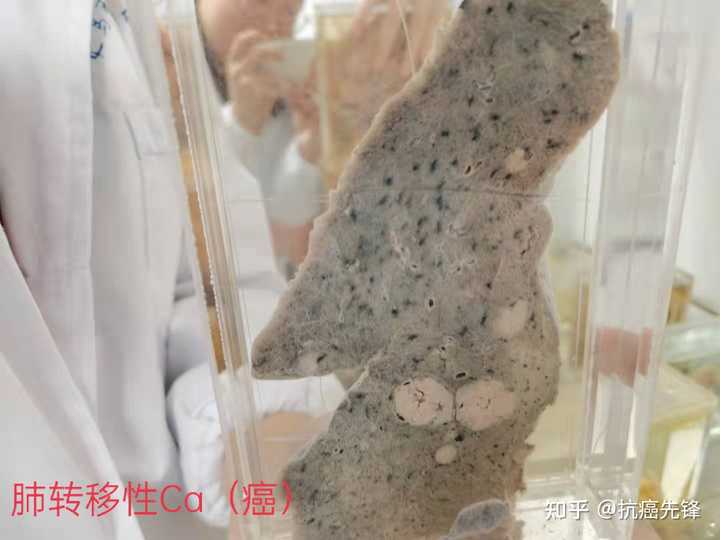
肿瘤周围会有较多血管,而且临床上也会把周围血管分布情况作为肿瘤良恶性的一个判断依据。恶性肿瘤一般血液供应非常丰富,不管是内部供血还是周边血管都是很丰富的,这个是恶性肿瘤和良性肿瘤主要的区别。良性肿瘤的特点主要是生长比较缓慢,边界比较清楚,有完整包膜,血液供应相对来说不是那么丰富。 然后题主想看肿瘤照片,建议可以查阅一些病理相关的书籍,有很多包括肿瘤影像报告图、病理切片图、大体标本图等等,还是很容易找到的。 |

|
|
|
|
|
|
|
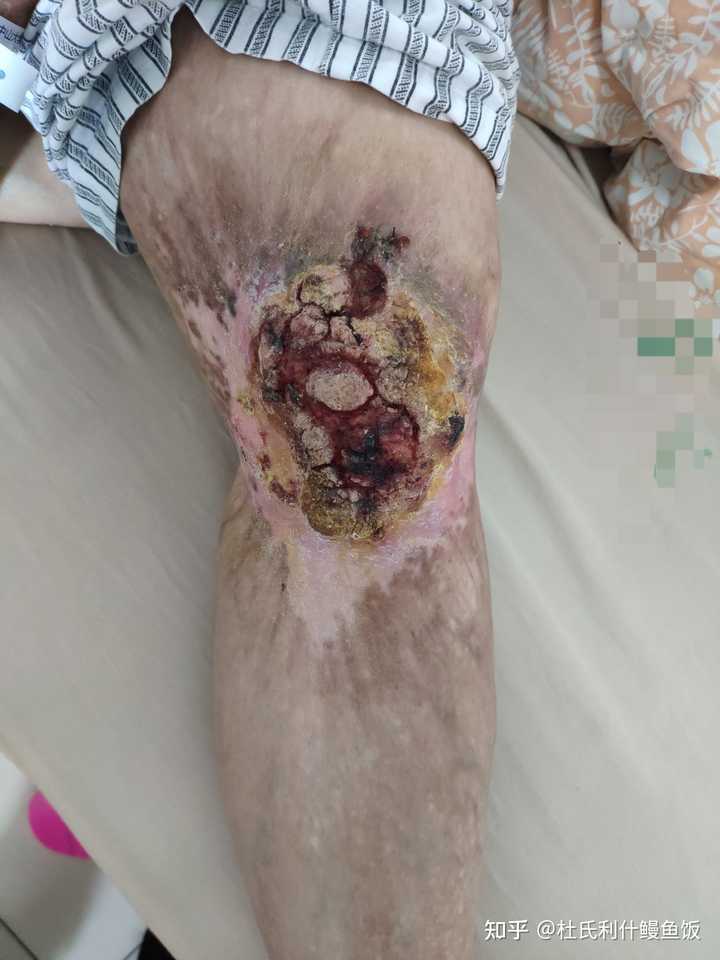
放几张实拍图吧 左腿 基底细胞癌 |
|
|
|

|
|
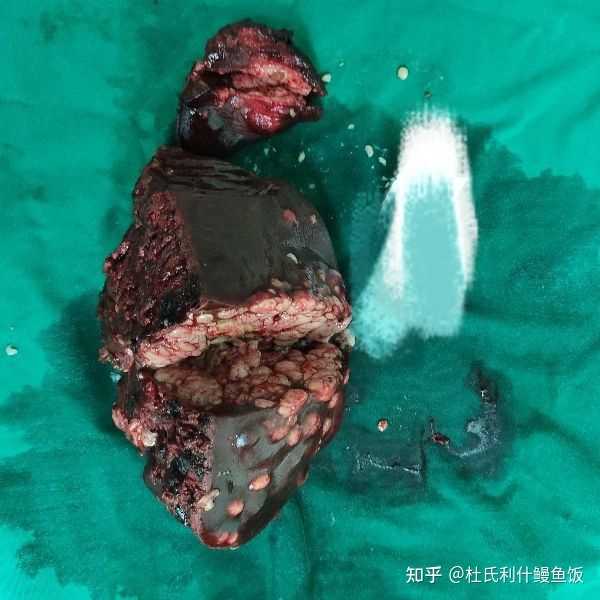
该图片有可能会引起不适 继续查看 2. 肝癌 伴局部转移 |
|
|
淡粉色或者白色的那些小结节就是肝癌病灶。这个切面可以看到布满了白色结节,其他地方也有一些孤立的散在结节。这个病例当时已经发生了肝内局部转移,但还在手术可切除范围内。 3. 腹膜后肿瘤 比较罕见的节细胞神经瘤 |
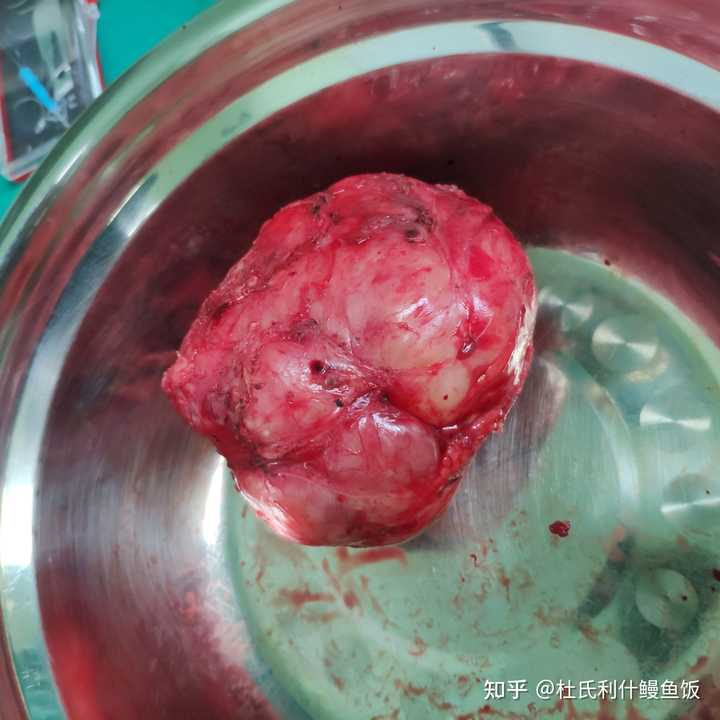
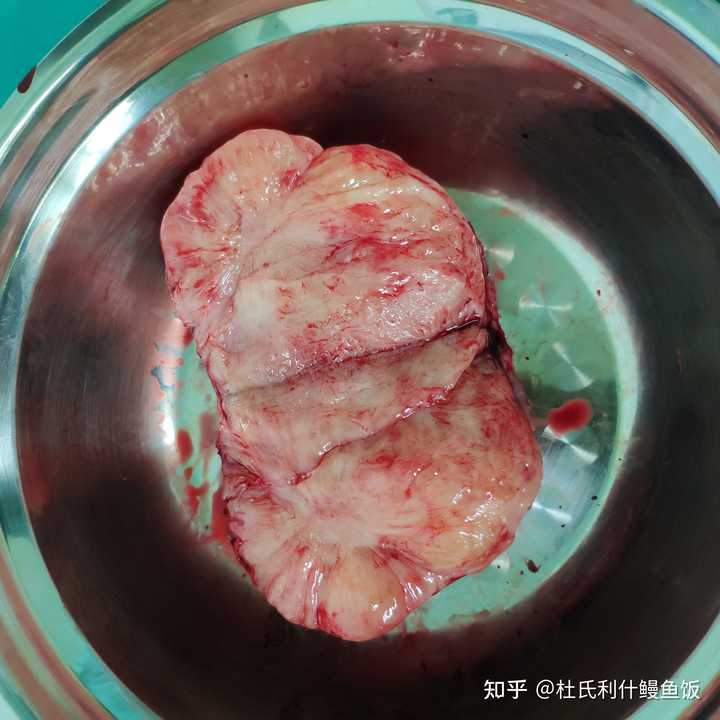
|
|
|
|
|
切开和未切开的照片。 这个病例我印象很深,是个7岁小女孩,腰痛就诊。腹部ct提示腹膜后10cm占位考虑恶性。手术中切除了肿瘤剖下来看切面也有点鱼肉样的结构和质感,这是肉瘤的一个特征。当时我们还想完了完了。没想到后来病理报节细胞神经瘤,属于比较罕见的一种良性肿瘤!太好了 4. 肾癌 |
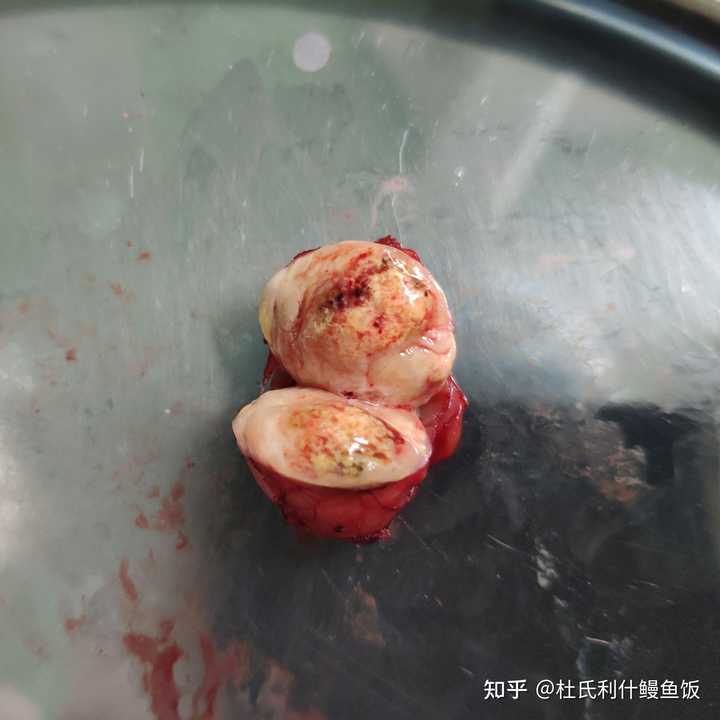
|
|
已经剖开了。可以看到切面五彩斑斓有各种颜色。这个是肾癌的一个特征,切面为“五彩样” 所以实际上肉眼是很难看到肿瘤的不同结构的,基本上还是实性结节为主。当然肿瘤的微观环境内由各种结构,包括肿瘤细胞,基质细胞,血管和细胞外基质等等。但是这些都是肉眼不可分辨的~ |
|
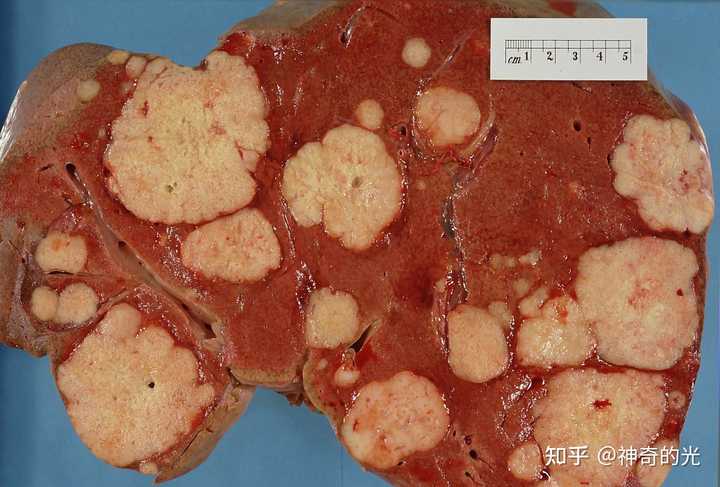
胰腺癌患者的肝脏解剖,可看到许多白色的来自胰腺癌的转移肿瘤。 |
|
|
|
|
要想知道肿瘤长什么样子,我们首先要知道肿瘤是什么。 肿瘤是一个相对泛泛的称呼,可以分为良性肿瘤和恶性肿瘤,而恶性肿瘤就是我们常说的癌症。 关于良性肿瘤:最常见的是脂肪瘤。通常摸起来软软的,患者自己通常没有明显的不适症状。 |
|
|
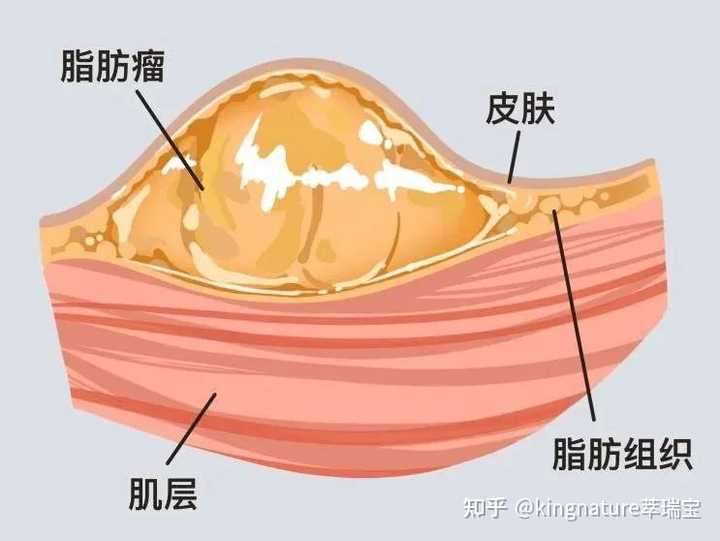
图片来源:《皮肤性病诊断与鉴别诊断》 其围观结构长这样: |
|
|
图片源于网络,如有侵权请联系删除 下面我们主要说一下恶性肿瘤,先来看其分类: |
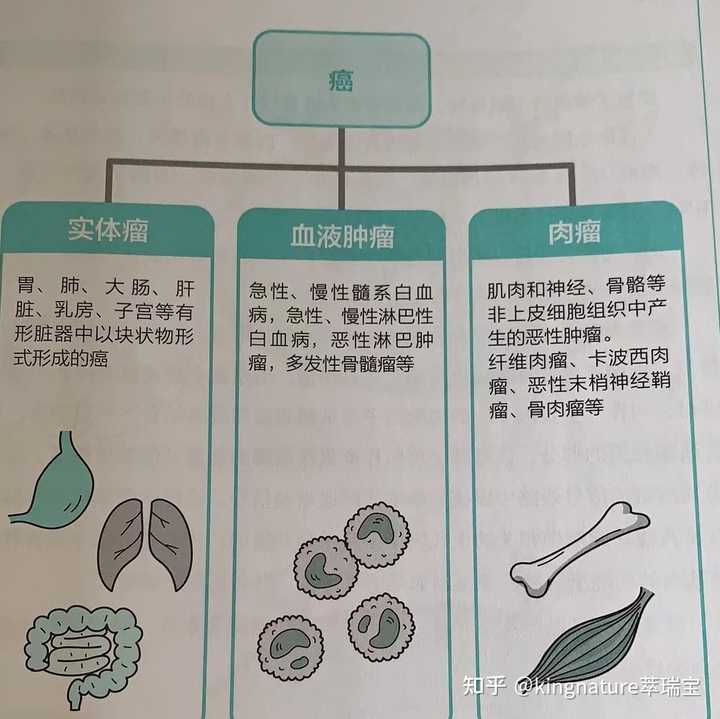
|
|
图片来源:《读懂肿瘤癌症》 没错,恶性肿瘤的表现多样,有的并不是我们传统印象中的呈现出块状或疙瘩状的表现形式,比如血癌,也就是我们常说的白血病。这也说明,并不是所有的肿瘤都会有血管缠绕在周围。 那么恶性肿瘤的类型多种多样,也没有我们潜意识里都有血管包绕的特征,他们有什么共同之处呢?这就不得不提一种只有肿瘤细胞才存在的细胞色素没CYP1B1。 英国《临床科学》杂志发表了一篇文章,文中指出,CYP1B1是一种肝外酶,CYP1B1的诱导在许多方面是有害的。首先,它可以诱发或加剧癌症治疗引起的心血管并发症。其次,它可能导致显著的化学/放射耐药性,破坏癌症治疗的安全性和有效性。且目前已有证据表明,CYP1B1在恶性肿瘤组织中过表达,特别是在激素反应性组织中。 |

|
|
那么,有没有可以针对CYP1B1发挥作用的植物营养素呢?答案是肯定的。Salvestroles属于一类重要的植物物质,它们在人类癌细胞中被肿瘤细胞特异性酶CYP1B1代谢,可触发许多不同的过程,直至细胞死亡,这一过程的最终结果就是导致癌症停滞甚至减少。 |
|
本人胰腺肿瘤,7cm? 图片可能会引起不适,请慎重考虑后观看 图片可能会引起不适,请慎重考虑后观看 图片可能会引起不适,请慎重考虑后观看 |
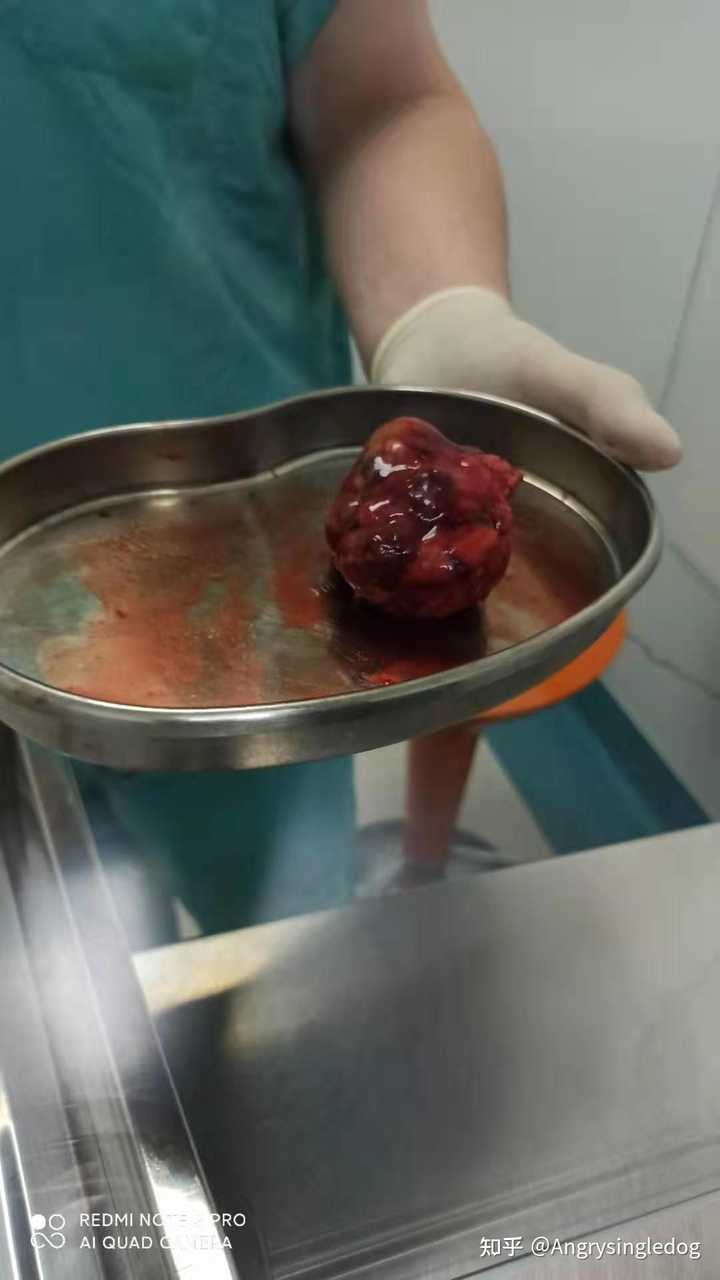
|
|
|

|
|
该图片有可能会引起不适 继续查看 |
|
上一张直观的图片 |
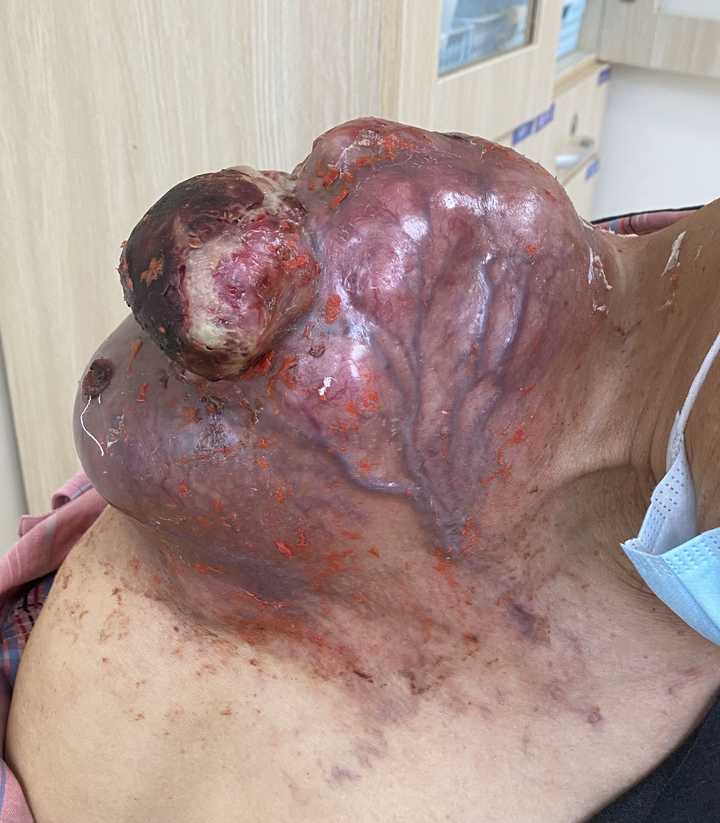
|
|
|
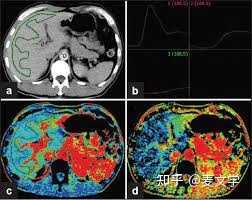
|
|
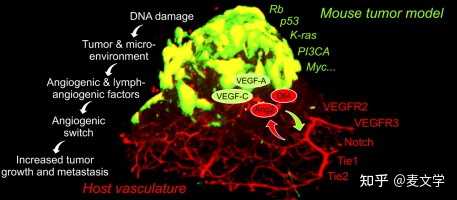
癌症有能力扩散到邻近或远处的器官,这使它对生命构成威胁。肿瘤细胞可以穿透血液或淋巴管,通过血管内循环,然后在另一个地方增殖:转移(Folkman 1971)。 对于癌症组织的转移性传播,血管网络的增长是很重要的。新的血液和淋巴管形成的过程分别被称为血管生成和淋巴管生成。两者在形成新的血管网络以供应营养物质、氧气和免疫细胞,以及清除废物方面都有重要作用(Folkman 1971)。血管生成和淋巴管生成因素越来越受到关注,特别是在肿瘤血管化领域。 |
|
|
血管网络的新增长很重要,因为癌细胞的增殖以及转移性扩散取决于氧气和营养物质的充分供应以及废物的清除。新的血液和淋巴管分别通过称为血管生成和淋巴管生成的过程形成。 血管生成受到激活剂和抑制剂分子的调节。已有十几种不同的蛋白质被确定为血管生成的激活剂和抑制剂。血管生成因子的表达水平反映了肿瘤细胞的侵略性。血管生成抑制剂的发现应有助于降低癌症的发病率和死亡率。 迄今为止,数以千计的患者已经接受了抗血管生成治疗。尽管抗血管生成治疗在理论上是有效的,但事实证明在长期生存方面并没有好处。在控制癌症方面,迫切需要一种新的综合治疗策略,将抗血管生成剂与传统的细胞修复治疗相结合。 肿瘤的生长和转移取决于处于快速生长阶段的肿瘤细胞的化学信号所引发的血管生成和淋巴管生成(Folkman 1971)。 在以前的一项研究中,Muthukkaruppan及其同事(1982)比较了注入同一器官不同区域的癌细胞的行为。一个区域是有血液循环的虹膜;另一个是没有血液循环的前室。没有血液循环的癌细胞生长到1-2mm3的直径,然后停止,但当放在一个可能有血管生成的区域时,生长超过2mm3。在没有血管支持的情况下,肿瘤可能会坏死甚至凋亡(Holmgren等人,1995;Parangi等人,1996)。因此,血管生成是癌症进展中的一个重要因素。 新生血管,包括肿瘤血管生成,基本上是一个四步的过程。 首先,组织中的基底膜被局部损伤。立即出现破坏和缺氧。 第二,由血管生成因子激活的内皮细胞迁移。 第三,内皮细胞增殖和稳定。 第四,血管生成因子继续影响血管生成过程。 血管内皮细胞平均每1000天左右才分裂一次(Denekamp 1993)。当肿瘤组织需要营养和氧气时,血管生成会受到刺激。血管生成受到激活剂和抑制剂分子的调节。然而,血管生成因子活性的上调本身并不足以实现肿瘤的血管生成。血管生长的负性调节剂或抑制剂也需要被下调(Dameron等人,1994年)。 已有十几种不同的蛋白质被确定为血管生成的激活剂,包括血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)、血管生成素、转化生长因子(TGF)-α。TGF-β、肿瘤坏死因子(TNF)-α、血小板源性内皮生长因子、粒细胞集落刺激因子、胎盘生长因子、白细胞介素-8、肝细胞生长因子和表皮生长因子。 血管内皮生长因子家族及其受体(VEGFR)在肿瘤血管化领域正受到越来越多的关注。VEGF在肿瘤组织和正常组织中都是一种强大的血管生成剂。在某些细胞因子和其他生长因子的影响下,VEGF家族出现在癌组织和邻近的基质中,并在新生血管中发挥重要作用(Folkman 1990, 1995a, 1995b)。 一些血管生成表型可由缺氧引发,缺氧是由于生长中的肿瘤细胞与毛细血管之间的距离增加或新血管的效率低下而造成的。低氧通过低氧诱导因子-1α(HIF-1α)诱导VEGF及其受体的表达(Bottaro和Liotta 2003)。肿瘤细胞通过产生VEGF,然后将其分泌到周围的组织中,以新的血管为食。当肿瘤细胞遇到内皮细胞时,它们与内皮细胞外表面的受体结合。血管内皮生长因子与其受体的结合激活了中继蛋白,将信号传递到内皮细胞的细胞核中。该核信号促使一组基因制造新内皮细胞生长所需的产品。 被血管内皮生长因子激活的内皮细胞产生基质金属蛋白酶(MMPs)。MMPs分解细胞外基质,该基质填充在细胞之间的空间,由蛋白质和多糖组成。这种基质允许内皮细胞的迁移。内皮细胞在迁移到周围组织时开始分裂。很快它们组织成空心管,在粘附因子,如整合素α或β的帮助下,逐渐演变成一个成熟的血管网络(Mizejewski 1999;Nelson等2000)。新形成的血管需要稳定或成熟。血管紧张素-1、-2及其受体Tie-2可以稳定和支配血管生长(Suri等人1996;Maisonpierre等人1997;Tournaire等人2004)。 在VEGF家族中,VEGF-A、VEGF-B、VEGF-C和VEGF-E作用于各自的受体,引起血管的增殖,而VEGF-C和VEGFD参与淋巴管的生成(Neufeld等,1999;Mandriota等,2001;Rafii和Skobe 2003)。血管内皮生长因子-A也被称为血管内皮生长因子/血管通透性因子(VPF)(Leung et al 1989)。人类血管内皮生长因子-A基因已被映射到6q21.3(Vincenti et al 1996)。血管内皮生长因子-A是一种肝素结合的糖蛋白,至少有六种分子异构体,由121、145、165、183、189和206个氨基酸组成,是mRNA替代剪接的结果(Ferrara等1992;Ferrara 1996;Stalmans等2002)。 VEGF-A是血管内皮细胞的强效和非常特异的有丝分裂原,刺激血管生成所需的全部事件(Leung等人,1989;Conn等人,1990),并在各种肿瘤中过度表达(Dvorak 2002)。VEGF-B以两种蛋白异构体存在,即VEGF-B167和VEGF-B186,由不同的mRNA剪接而成,并与VEGFR-1特异性结合。然而,VEGF-B与VEGF-A形成异质二聚体(Olofsson等人,1996年),这可能改变其与生物受体的相互作用,并改变其正常的生理效应。虽然VEGF-B在心脏、骨骼肌和血管细胞中广泛表达(Olofsson等,1996;Yonekura等,1999),但其生物学功能仍不清楚。也有报道说,VEGF-B的水平在整个发育过程中和出生后都会增加,与心脏血管生成的进展密切相关(Bellomo等人,2000)。VEGF-C有一个成熟的形式,由一个VEGF同源结构域组成,它含有受体结合位点,与VEGF165的氨基酸序列有30%相同(Joukov等人,1998年)。与VEGF-A不同,VEGF-C的表达似乎不受缺氧的调节(Enholm等人,1997)。VEGF-C的表达似乎仅限于早期发育和某些病理情况,如肿瘤血管生成和淋巴管生成(Peeper 2001)。VEGF-D被称为c-FOS诱导的生长因子(FIGF),其成熟形式与VEGF-C的氨基酸序列有61%相同,这两种生长因子与人类内皮细胞上的相同受体,即VEGFR-2和-3结合(Orlandini等人1996;Achen等人1998;Baldwin等人2001)。VEGF-C和VEGF-D结合并激活VEGFR-3,调节淋巴管生成以及胚胎发育中期的血管生成(Migdal等人1998;Soker等人1998)。VEGF-E由副痘病毒或Orf病毒编码(Lyttle et al 1994)。VEGF-E与其受体的相互作用似乎能促进内皮细胞的生长(Ogawa et al 1998)。VEGF-A和VEGF-E在VEGFR-2上的结合袋有明显的重叠,这可能表明这两种分子在最终反应中的联合,或者这两种因素之间的拮抗关系(Kiba et al 2003)。 一些研究表明,血管生成的激活剂在肿瘤的生长和扩散中起着重要作用。在免疫组织化学检查中,发现VEGF家族及其受体在所调查的人类癌症中约有一半表达(Salven等人,1998年)。这些因素已知会影响子宫颈(Hashimoto et al 2001)、子宫内膜(Hirai et al 2001)、卵巢(Boocock et al 1995;Yokoyama et al 2003;Nishida et al 2004)和胃(Yonemura et al 1999;Amioka et al 2002)的腺癌的预后。此外,VEGF的表达与预后之间有显著的相关性,在结直肠癌(Andre等2000;George等2001;Furudoi等2002)、乳腺癌(Kurebayashi等1999;Gunningham等2000。Kinoshita等2001;Skobe等2001),肺癌(Decaussin等1999;Niki等2000;Kajita等2001),头颈部鳞状细胞癌(O-charoenrat等2001),卡波西肉瘤(Jussila等1998)和恶性间皮瘤(Ohta等1999)。这些研究还表明,组织中的血管生成因子水平反映了肿瘤细胞扩散的侵略性,因此对识别预后不良的高危患者具有预测价值。 新生血管减少了肿瘤对化疗药物的可及性。在相对缺乏瘤内淋巴管的情况下,肿瘤内渗漏的血管产生的间质压力增加,导致血管压迫和中心坏死(Folkman 1995b)。因此,肿瘤性血管生成因子的预后价值存在争议也就不足为奇了。 |
|
|
ref |
|
|
皮肤平滑肌瘤,可爱吧。全身三百多个 |
|
|
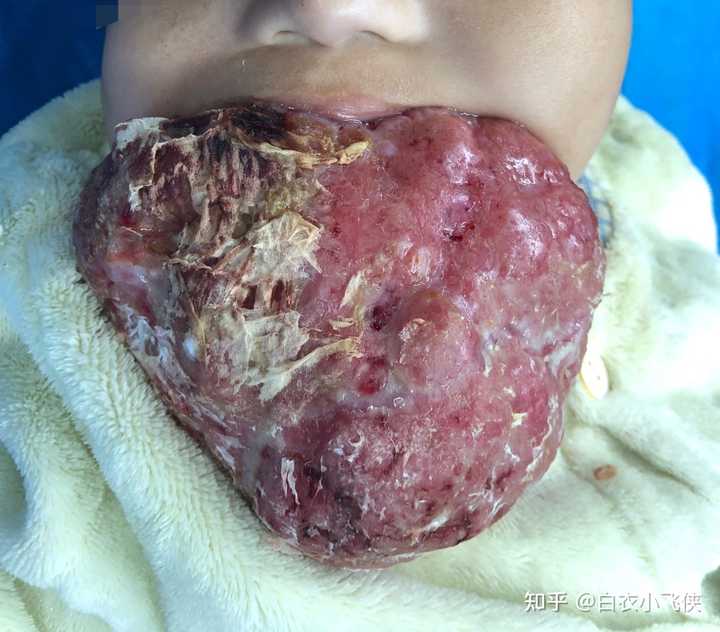
是时候放个大招了。 作为一名麻醉医生,最怕的就是这种病人。 这是我曾经接手的一名只有6个月大的宝宝。 我去访视病人的时候,他整个口腔都被肿瘤堵住了,CT和MRI我没拍,肿瘤是从舌下腺的位置发出,口腔内长满后向外发展,一直到现在这个位置。用手触碰感觉质地很韧,但是不知道内部是软是硬,血供如何。 我当时头都大了。万幸的是咽喉部和气管没有受到影响但是巨大的肿瘤已经开始从外面压迫气管了。跟外科医生沟通后,他们表示先取活检,再根据活检的结果决定下一步手术方案。 如果是成人可以配合操作,几分钟就可以搞定,但是小宝宝他闹腾啊,不麻醉不行。但是麻醉风险很大,尽管外科跟我说他们做得很快,切下来一点就可以了,是个小手术。然而我并没有掉以轻心,外科骗人的事多了去了(这里暂不控诉)。插不插管?插多大的?经口还是经鼻?要不要备气切?用什么药诱导和维持?术后恢复怎么做?每一项都在考验我,所谓只有小手术没有小麻醉。最后全科讨论后,决定先吸入麻醉,打留置针,基础麻醉,不插管。 手术当天太考验我的技术了。两个主任坐镇,我带着一个规培生麻醉。备好抢救器械和药品,根据宝宝的体重精确计算药量和液体量,把能监测上的仪器全用了,外科这次也很给力,说到做到,全程行云流水毫不犹豫,也没有出现术前想到的任何意外。手术做完送到恢复室5分钟不到就哇哇大哭。 但是结局挺让我伤心的,活检的结果出来后确诊为恶性(具体名称我忘了),家属签了字就出院了,后面再没有他们的消息。 |
|
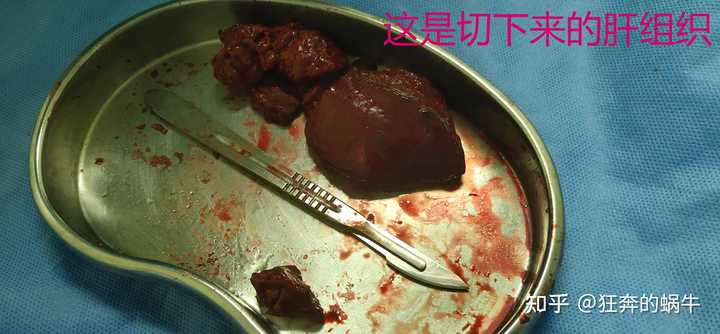
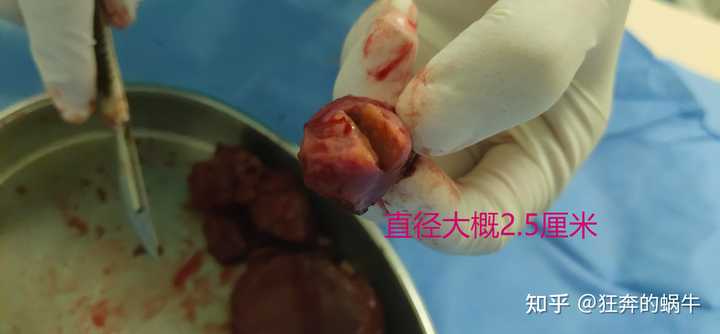
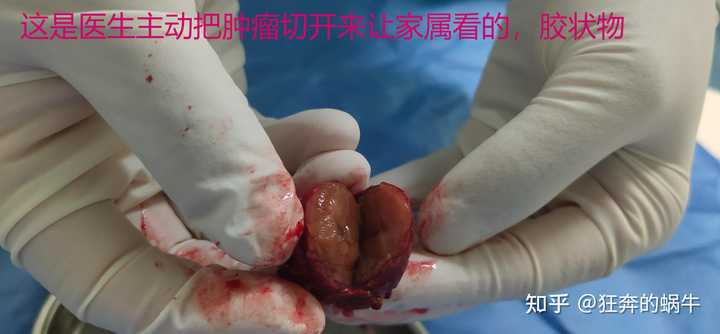
满足你的好奇心,图片呈现的是我爸的肝癌肿瘤图片 如果到这里你还是坚持要看的话那我就不阻拦你了 |
|
|
|
|
|
|
|
|
|
|
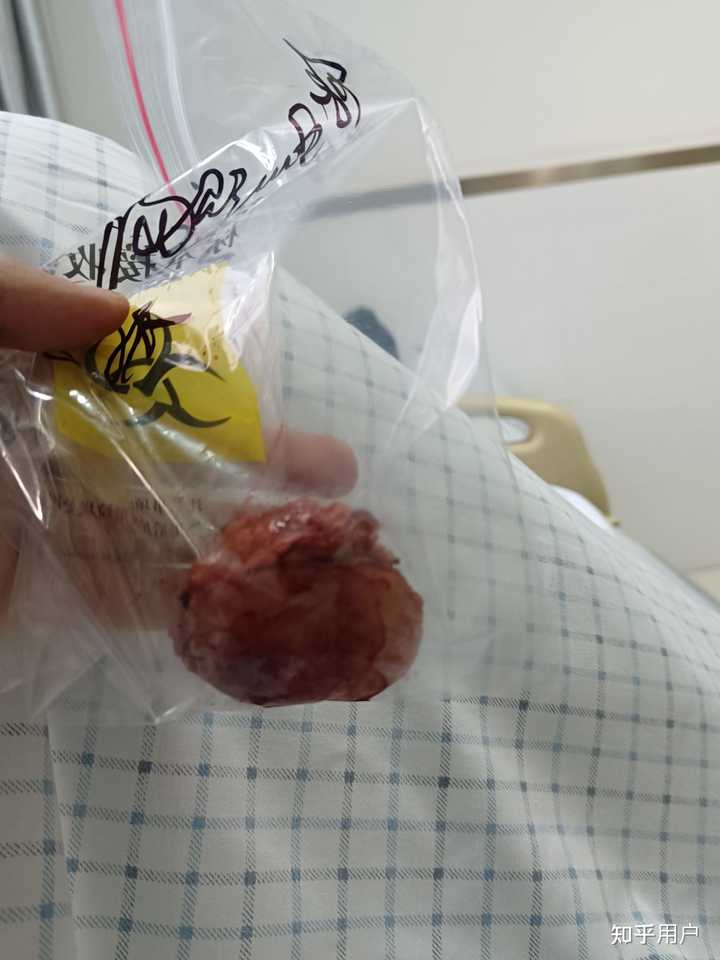
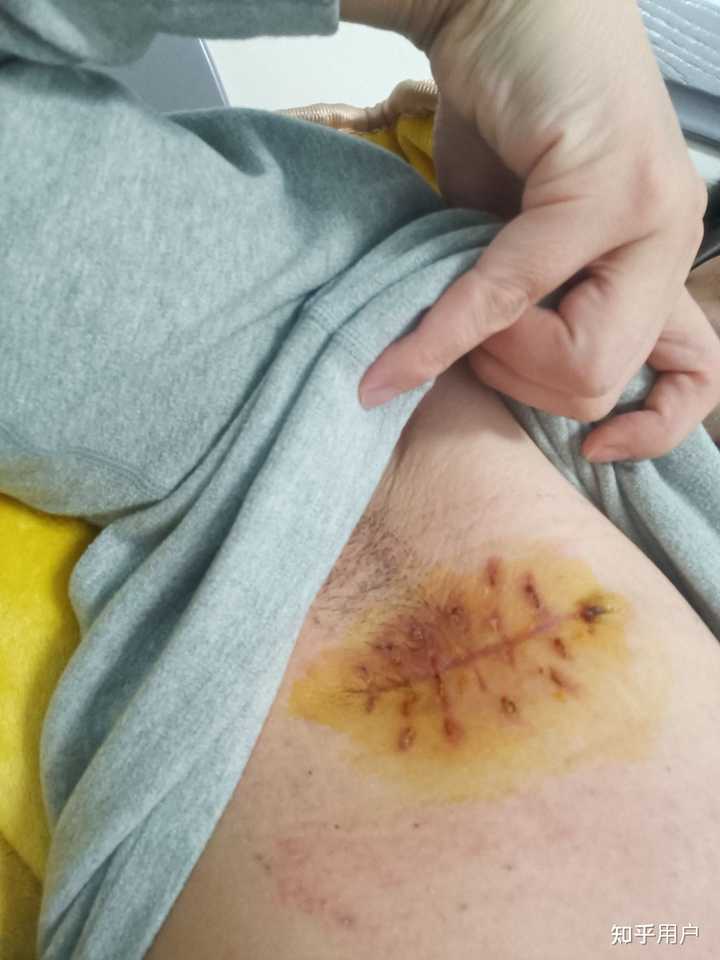
弥漫大b型淋巴瘤,长在浅表 术前 |

|
|
切下来的 |
|
|
术后 |
|
|
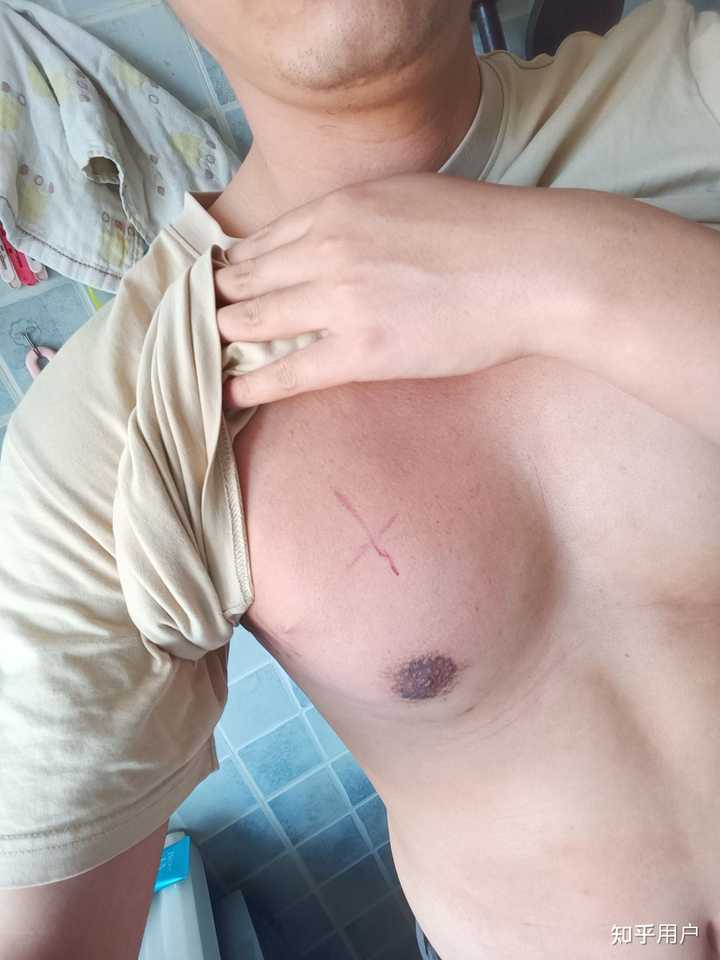
因为长在浅表发现的早,属于1期a组,治疗相对也简单点。(其实不切也行 ,但是一开始没想到是恶性的) 还有一次化疗就结束啦啦啦 5月22日 化疗已经结束一段时间了,靶向还剩一次,然后医生追加了一些放疗 |

|
|
每天一早去做放疗,做完了去上班,好在医生知道我要工作,每次都把我排在第一个 ,已经做了11次了,除了白细胞略低,其他一切ok 5月30日 放疗已经结束啦,除了皮肤有些发红,其他都挺好,歇了太久没锻炼,胸肌腹肌都没了,等结疗了一定要恢复健身,还剩一次靶向 |
|
|
2023/6/12日 最后一次靶向也结束了,正式结疗。 等身体恢复一段时间就重新开始撸铁 |
|
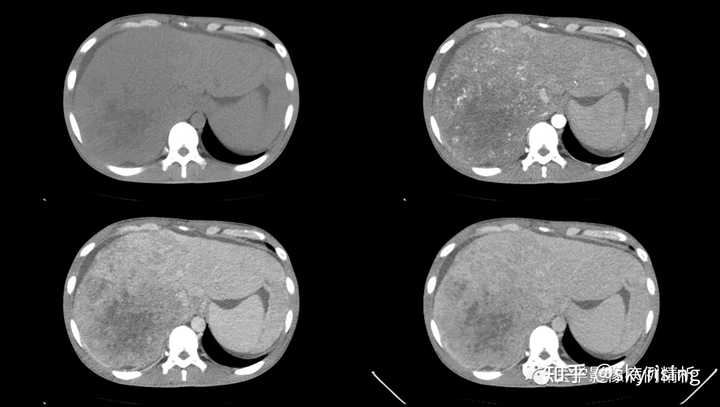
本文略长,图片较多,阅读需10分钟。 本文通过一例肝脏恶性肿瘤并全身多发转移报告书写,进一步探讨CT增强诊断技术对于图像显示的影响,最后给出一系列各种风格的报告范例。 2022年第3期【临床信息】 现病史:患者青年男性,31岁,因“确诊肝恶性肿瘤2周余,进一步治疗”入院。于2周前无明显诱因出现右上腹部疼痛,最初呈闷胀样疼痛,尚可忍受,可自行缓解,当日突发剧烈疼痛,难以忍受,无其它部位放射痛,无大汗淋漓。KPS评分:100分。VRS评分:0级。 专科检查:肝病面容,皮肤及巩膜黄染,全身浅表淋巴结未及肿大,颈静脉稍怒张。 既往史:有慢性乙型肝炎病史多年,曾抗病毒治疗,自行停药;否认输血史,否认高血压、冠心病、糖尿病等慢性病史,否认结核、痢疾等传染病史及接触史,否认食物药物过敏史,否认外伤史。 外院胸部CT提示:肝多发占位,Ca?,考虑肝硬化、脾大,胆汁淤积或泥沙样结石,腹腔积液,建议CT或MRI增强检查。 甲胎蛋白AFP>1210.0ng/ml。 【影像图片】 全腹CT平扫+增强,分别为平扫、动脉期、门脉期、平衡期: |
|
|
|
|
|
|
|
|
|

|
|
|
|
|
下图平扫调整为肺窗 |
|
|
|
|
|
下图门脉期MPR重建 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
下图显示肝门区 |
|
|
骨窗MPR重建 |
|
|
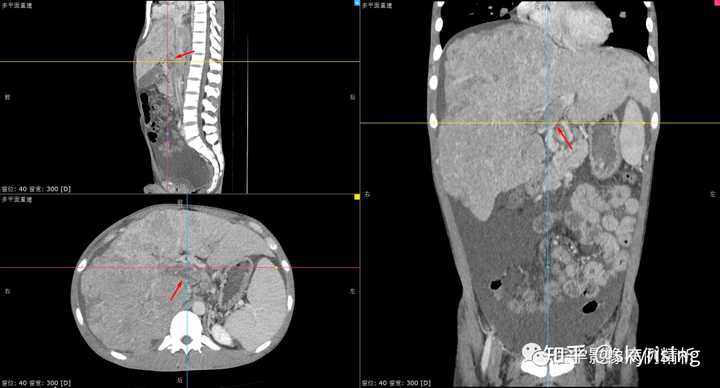
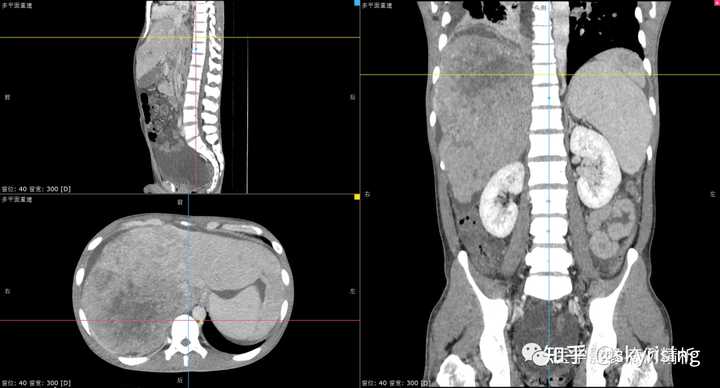
请问如何鉴别诊断?如何书写报告? 【影像分析】 正常门静脉强化的影像图片,可清晰看到强化门静脉血管影,左右支显影清晰,右前后支及左内支显影良好,管壁光整,未见充盈缺损影。 |
|
|
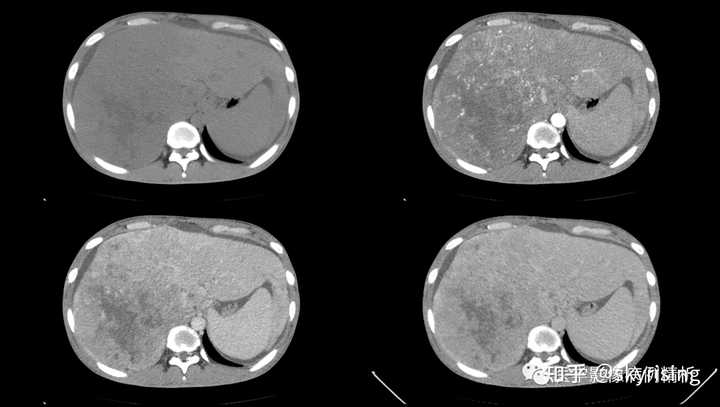
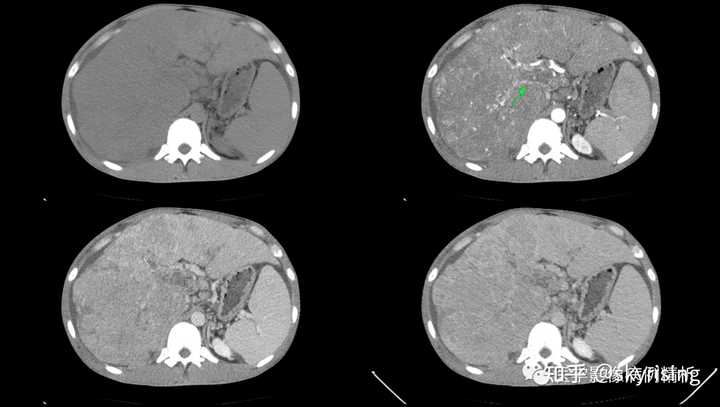
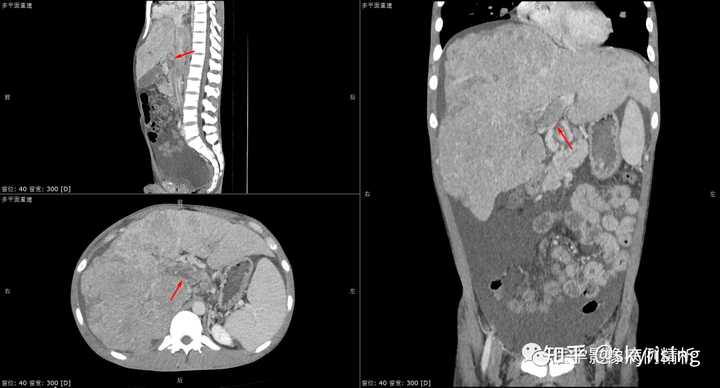
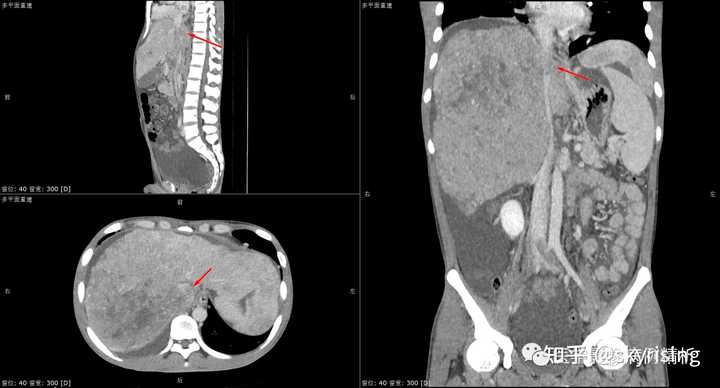
以下为全腹CT平扫+增强,分别为平扫、动脉期、门脉期、平衡期。平扫可见肝右叶为主巨大软组织肿物及多发稍低密度结节,边界弥漫不清,中心见大片状囊变坏死,增强动脉期病灶边缘斑片状轻度强化,并见多发迂曲强化小血管影,门脉期及平衡期强化迅速减低,呈速升速降型。 本例增强时机掌握不精准,动脉期注意腹主动脉强化明显、均匀,脾脏花斑样强化未见明确显示,考虑扫描时机偏晚为动脉晚期或患者动脉血流异常;门脉期、平衡期显影尚可。 各层面注意脾大。 |
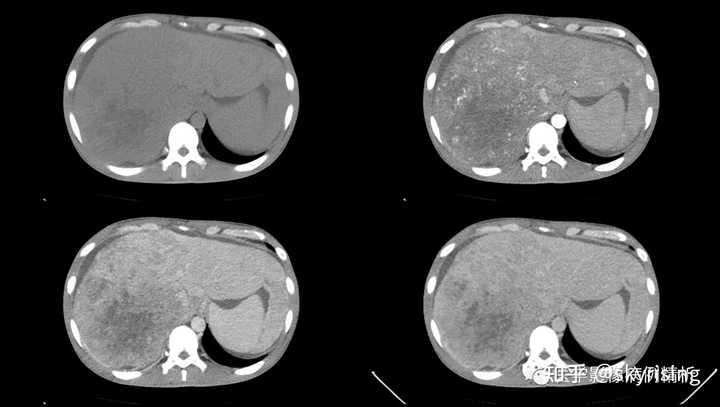
|
|
|

|
|
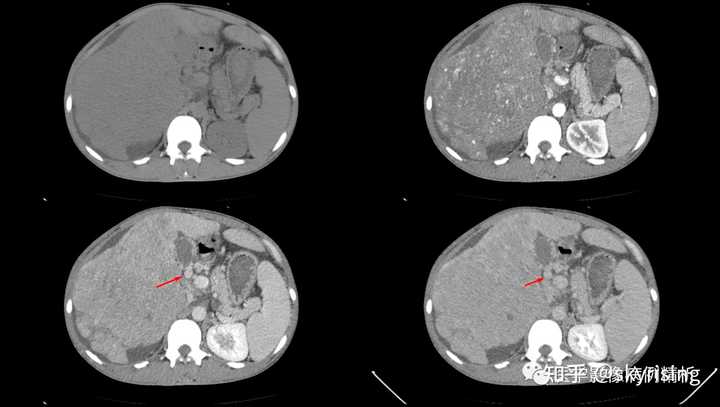
下3图绿色箭头所示为门静脉左右支分叉及主干层面,可见条形充盈缺损影,未见强化。当门静脉或下腔静脉出现癌栓,需要警惕门静脉海绵样变,注意第3图肝门区迂曲强化小血管影,个别病例会增粗异常明显如同血管畸形一样,不要误诊。 |
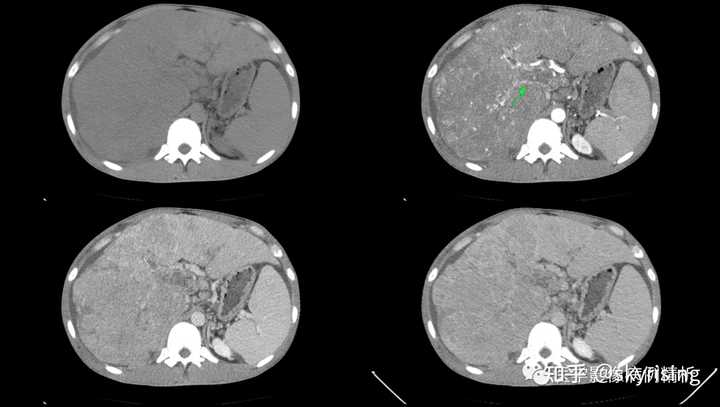
|
|
|
|
|
|
|
|
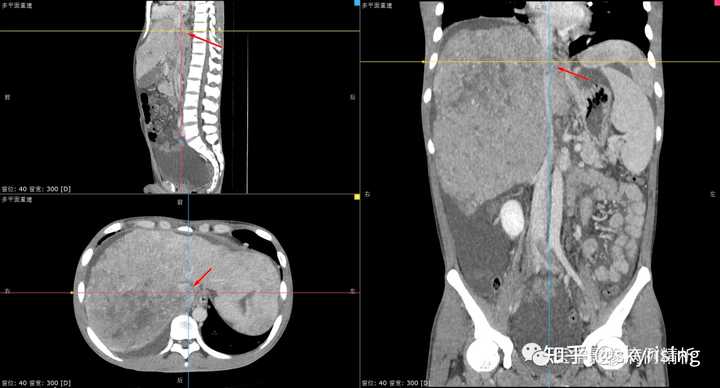
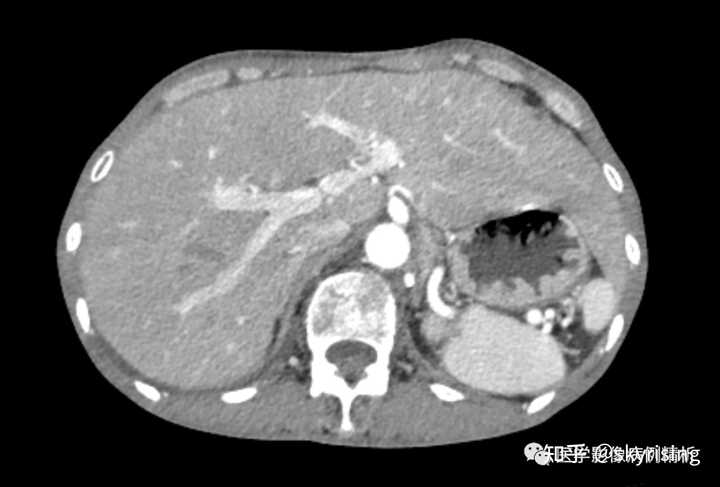
下图所示绿色箭头为肝周大量积液低密度影,肝实质边缘毛糙,凹凸不平呈扇贝样压迹改变,提示肝硬化。 |
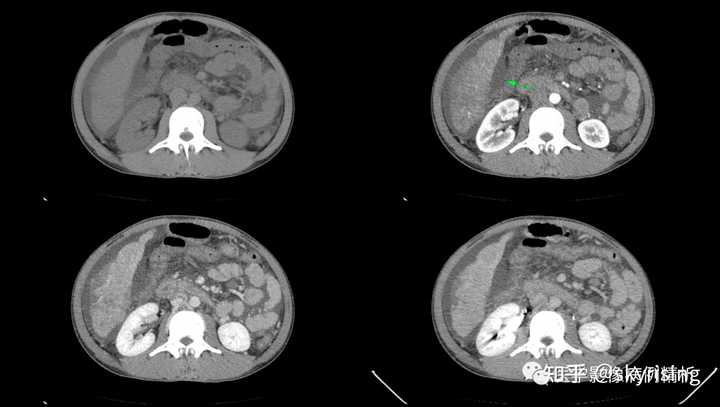
|
|
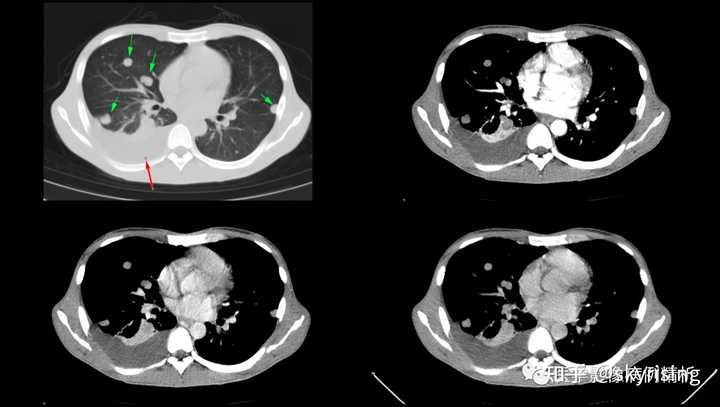
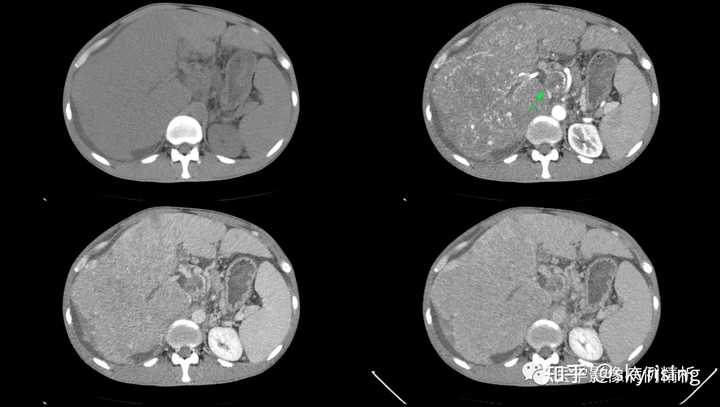
下图所示绿色箭头可见肺内多发转移瘤,边界清晰,密度均匀,分布以胸膜下区为著,提示血运转移。红色箭头所示为右侧胸腔大量积液,右肺下叶局灶性肺不张,软组织呈实变影 |
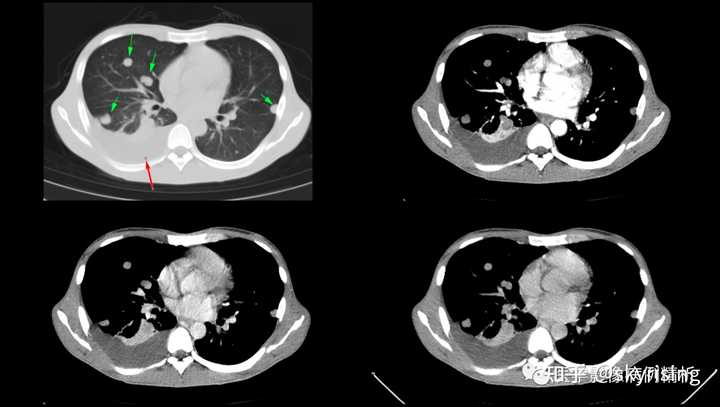
|
|
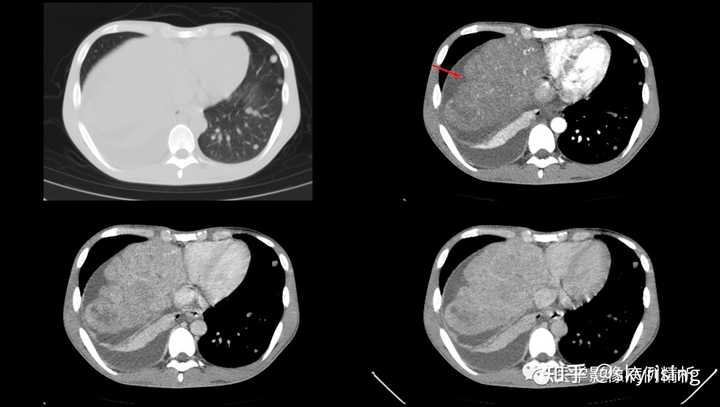
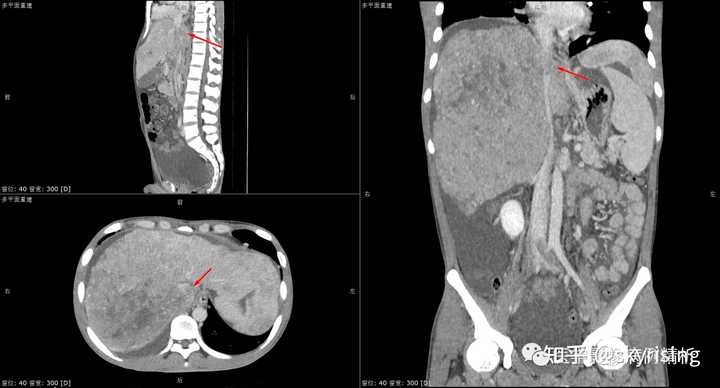
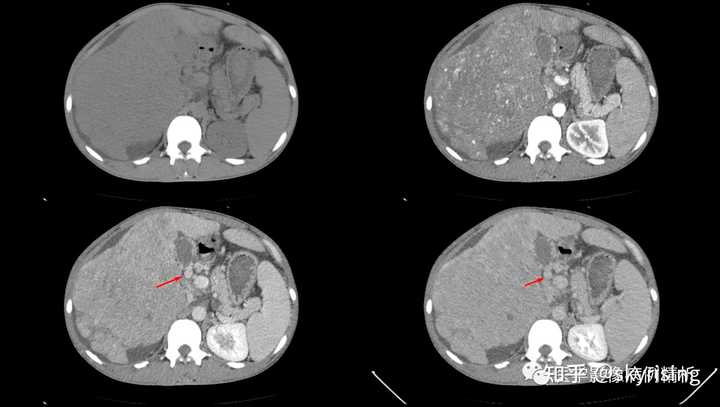
下图所示红色箭头为肝脏边缘凹凸不平呈扇贝样压迹改变,局部肝裂凹陷,也有名称叫咳纹肝。肝实质密度明显不均,可见多发速升速降强化方式小结节,考虑转移或肝癌 |

|
|
增强门脉期MPR重建,红色箭头所示为门静脉癌栓,从冠矢轴三个角度观察癌栓形态,堵塞主干及左右支分叉处。 |
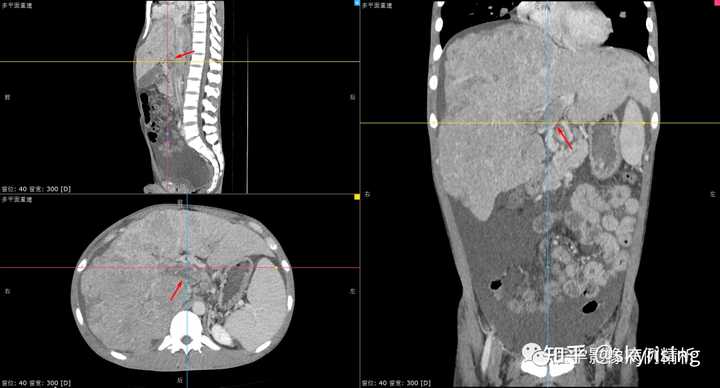
|
|
|
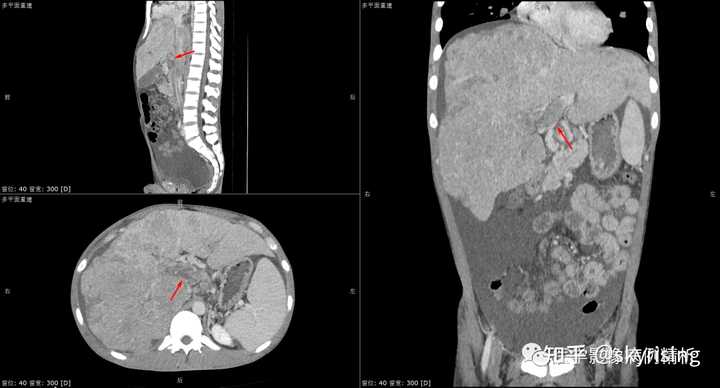
|
|
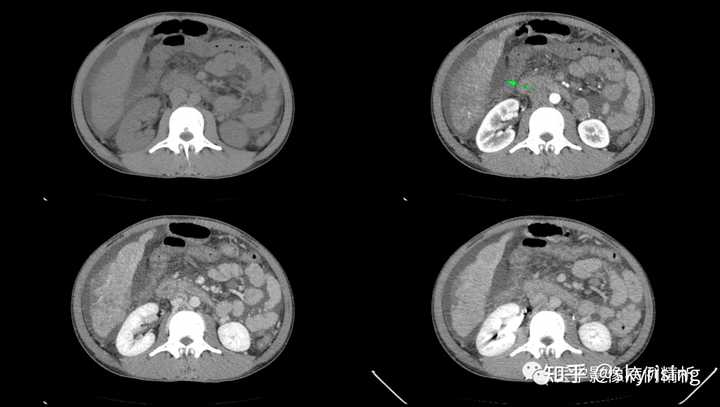
下图为下腔静脉肝段受压或癌栓形成,注意所示下腔静脉肝段压迹明显,边界不清,上下段显影尚可,局部纤细。 |

|
|
|
|
|
下图为增强门脉期MPR重建全腹显示,注意肝脾体积弥漫性增大,右肾受压略下移,右侧膈肌可疑受侵,右肺下叶肺不张、右侧胸腔积液,腹盆腔大量积液。 |

|
|
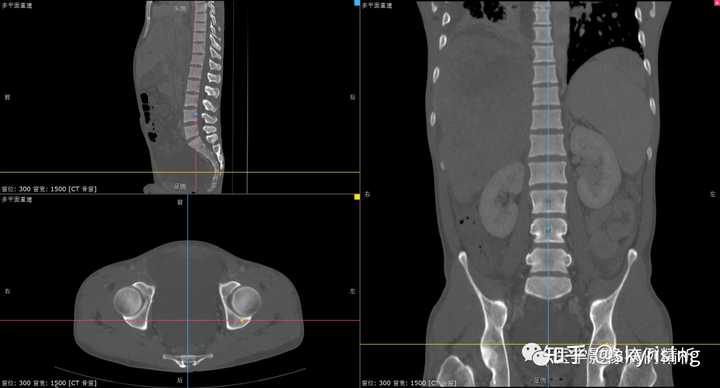
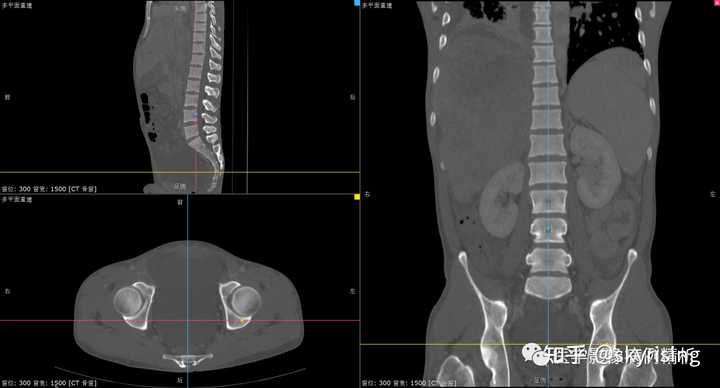
骨窗MPR重建骨质未见破坏,提示骨质无转移。 |
|
|
汇总分析: 1、病史:患者青年男性,31岁,因“确诊肝恶性肿瘤2周余,进一步治疗”入院;慢性乙型肝炎多年,治疗效果不佳;专科检查,肝病面容,皮肤及巩膜黄染。甲胎蛋白AFP>1210.0ng/ml。外院CT提示:肝多发占位,Ca?,考虑肝硬化、脾大,胆汁淤积或泥沙样结石,腹腔积液,建议CT或MRI增强检查。以上均提示肝脏恶性肿瘤,原发性肝癌可能性大,胆管受侵。 2、影像分析:肝实质多发软组织肿块及结节影,密度不均,中心囊变坏死,增强边缘斑片状轻度强化、可见多发强化小血管影,呈速升速降强化方式,囊变区未见强化;门静脉主干及分支癌栓、可疑下腔静脉癌栓或受侵;双肺多发转移瘤、腹膜后多发淋巴结转移,骨未见转移。余病变详见报告模板。 3、分析小结:病史明晰,影像典型,符合原发性肝癌并多发转移,癌栓形成。需要注意与间叶组织来源的各种肉瘤鉴别,体积更大,转移并不少见,恶病质明显,总之恶性肿瘤肯定。 【报告书写范例】 本例为全身CT平扫+增强扫描,包括头颅、颈部、胸部、全腹,只给出了关键图像。报告只关注重点病灶,余未提及。 检查技术: 头部+颈部+胸部+全腹CT平扫并肝脏CT三期增强,患者体重60kg,对比剂剂量90ml,层厚3mm,间距3mm。 报告描述: 肝实质内见巨大软组织团块及多发稍低密度结节影,主病灶位于右叶, 最大范围约xxxcm,局部外突,边界模糊,密度明显不均,CT值约Hu,中心见多发囊性低密度影,增强动脉期主病灶边缘斑片状轻度强化,门脉期及平衡期迅速减低,呈速升速降型,并见多发迂曲强化小血管影,中心囊变区未见强化。门静脉增粗,最大径约cm,主干及左右分叉处见条形充盈缺损影,最大范围约xxxcm,远端分支显影欠佳;食管下段、胃底旁、脾门区多发迂曲强化血管影;下腔静脉肝段局部受侵、管腔略狭窄、边缘毛糙,邻近上下段显影尚可。腹主动脉及腹腔干、肠系膜上动脉显影清晰,管壁光整,管腔未见狭窄。肝门区见多发迂曲强化小血管影,显影中等。 肝脏体积弥漫性增大,左右叶比例失调,肝门、肝裂增宽,实质边缘凹凸不平呈扇贝样压迹改变,右叶部分包膜凹陷,实质密度明显不均。 肝门区、肝胰间隙、腹膜后腔静脉间隙可见多发软组织结节影,最大约cm,密度均匀就,CT值约Hu,增强轻度强化。 双肺各叶见散在多发软组织结节影,最大约cm,边界清晰,CT值约Hu,增强轻度强化。 余正常描述头颈部。。。 右肺下叶见条片状高密度影,边界模糊,下叶近膈基底段呈软组织实变。 右侧胸腔背侧见液体密度影。 脾脏体积明显增大,超过x个肋单元,下缘近脐水平,密度均匀,增强未见异常强化。 腹盆腔见大量液体密度影。盆腔最大深径约cm。 中轴骨及附肢骨骨质未见异常。 汇总型报告结论: 1、肝脏恶性占位性病变,合并肝内多发转移、双肺多发转移、肝门及腹膜后多发淋巴结转移,门静脉癌栓形成,可疑下腔静脉肝段受侵,建议PET-CT检查。 2、右肺下叶炎症、部分肺不张;右侧胸腔积液。。。。 3、肝硬化、脾大、腹盆腔大量积液、门静脉高压、侧枝循环开放、肝门静脉海绵样变。 简约型报告结论: 1、肝脏恶性占位性病变,合并肝内多发转移、门静脉癌栓形成,可疑下腔静脉肝段受侵,建议PET-CT检查。 2、双肺多发结节,考虑转移。 3、肝门及腹膜后多发肿大淋巴结,考虑转移。 4、右肺下叶炎症、部分肺不张;右侧胸腔积液。。。。 5、肝硬化、脾大、腹盆腔大量积液、门静脉高压、侧枝循环开放、肝门静脉海绵样变。 选择性报告结论四: 1、肝脏恶性占位性病变,合并肝内多发转移、门静脉癌栓形成,可疑下腔静脉肝段受侵,原发性肝癌?间叶组织恶性肿瘤?,建议PET-CT检查。 2、双肺多发结节,考虑转移。 3、肝门及腹膜后多发肿大淋巴结,考虑转移。 4、右肺下叶炎症、部分肺不张;右侧胸腔积液。。。。 5、肝硬化、脾大、腹盆腔大量积液、门静脉高压、侧枝循环开放、肝门静脉海绵样变。 【鉴别诊断】 病史明晰,无需鉴别。 【病理结果】肝细胞癌 【感悟】 浅谈CT增强技术对影像图片显示质量影响及解决方法。 诊断和技术不分家。三级以下医院还好,但是在三级以上医院已经完全分开,各干各地。部分医院专门设立值班医生跟班负责图像质量,这个很好,但不好推广。诊断医生对于技术有正负反馈,好的积极支持,不好的努力协助分析纠正,形成良好的工作局面;技师接受反馈,及时修改纠正,对于图像质量把控为第一人,对于增强等短时效操作很考验人的经验。今天从影像诊断医生角度,以及我科指导技师操作的一些粗浅方法做小交流,主要从碘对比剂过敏、注射药物、针头、高压注射器操作几方面进行探讨。 一、碘对比剂过敏问题。 1、一般来做增强患者,技师习惯性问一句,能不能吃海带?因为海带富含大量的碘,一般能吃,说明问题不大,就是有问题,也是一些轻微的迟发过敏反应。 主要询问内容包括(1)既往有无使用碘对比剂出现中、重度不良反应史;(2)有无哮喘;(3)有无糖尿病;(4)有无肾脏疾病;(5)有无肾脏手术;(6)有无使用肾毒性药物或其他影响肾小球滤过率 (GFR) 的药物;(7)有无高血压;(8)有无痛风病史;(9)有无其他药物不良反应或过敏史;(10)有无脱水、充血性心衰现象。另外,甲状腺功能亢进尚未治愈者禁忌使用碘对比剂,糖尿病肾病患者使用前需要咨询专科医师。 2、过敏反应是碘对比剂最常见的不良反应,常常累及皮肤、心血管、呼吸和消化系统,其中最常见的不良反应是皮肤过敏反应且多为急性发作。过敏反应轻者表现为局限性的荨麻疹、瘙痒,重者会出现弥漫性颜面和喉头水肿、支气管痉挛和呼吸困难,发生过敏性休克甚或呼吸心脏骤停,如不经适当处理,可导致永久性疾病,甚至死亡。几乎所有危及生命的对比剂不良反应发生在对比剂注射后 20 分钟内。迟发性过敏样反应大部分是常见的皮肤反应,大多数发生于注射后 3 小时 ~ 2 日内。 过敏反应的处理采取对症处理,根据严重程度可给出内科观察、面罩吸氧、肌注或静脉给予 H1 受体拮抗剂、肌注肾上腺素(0.1 ~ 0.3 mg)、对症止吐、静脉补液升压等措施。目前尚没有证据证明使用碘对比剂前需要预防给药。 二、注射左右手选择。 尽量选择右手注射,《影像增强检查静脉输注工具规范应用专家共识》中有明确规定: 6.如果患者行 CT血管成像(CTA)检查,尤其是头颈动脉、冠状动脉、肺动脉 CTA 检查时,应尽量选择右侧上肢穿刺,可减少静脉伪影对图像质量造成影响。 个别肢体存在问题的可打同侧。 三、上肢静脉血管选择。 一般选择贵要静脉或正中静脉等比较粗大的血管,极个别特殊患者如老人、小孩选取手背、足背等粗大血管。 四、注射针头选择。 一般选择22号针头以上的,蓝色很特别,下段内容引用超然学医。 日常临床使用的注射器针头大小均有明确的标识,比如1ml针筒常用的针头多大型号,对应的G值多少。否则在临时使用时,不能明确不同针头的长度-直径和适用范围,无法准确获得最佳的针头。 号数越大,针头越细。G值表示的是Gauge值,值越大反而针头越细。G值都是衡量针头的外径。 |
|
|
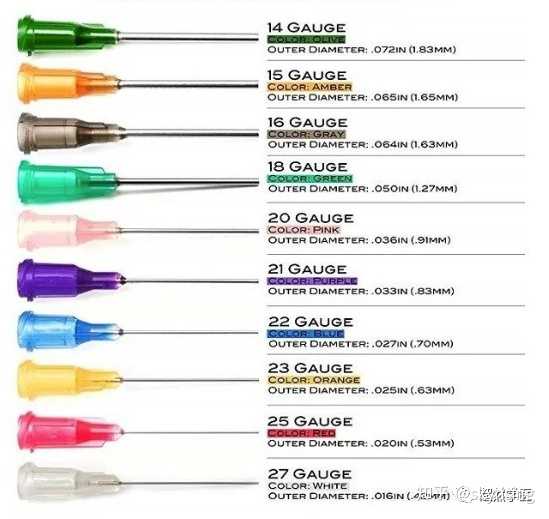
放一张不同G值的示意图 |
|
|
选择哪种型号的留置针? |
|
|
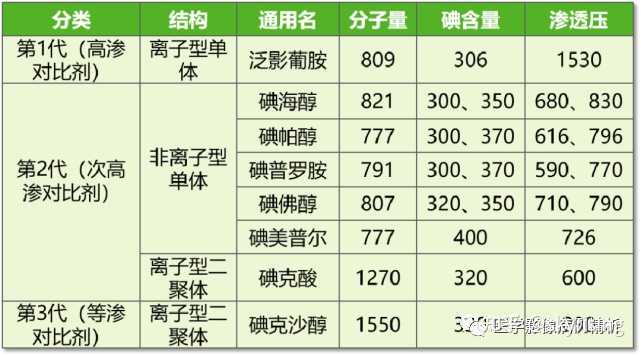
临床操作时最常用的是20G(红色留置针)。 我科常用22G蓝色留置针,没有出现血管异常。最早临床科室因采用24G针头,流速2.5ml/s,导致出现血管重度外渗,给患者造成心理负担非常大。后改用22G后,流速2.5-3.0ml/s,没有出现任何血管意外。 五、药品选择。 CT 检查使用的造影剂通常为碘对比剂,碘对比剂有三种分类方法:按照渗透压,分为高渗、次高渗和等渗对比剂按照其在溶液中是否电离,分为离子型和非离子型对比剂;按照其在溶液中是否电离,分为离子型和非离子型对比剂;按照化学结构,分为单体和二聚体型对比剂。高渗对比剂为离子型单体,其渗透压高达血浆渗透压的 5 ~ 7 倍,目前已很少使用。次高渗对比剂包括非离子型单体和离子型二聚体,其渗透压约为血浆渗透压的 2 倍。等渗对比剂为非离子型二聚体,其渗透压与血浆渗透压相等,详见下表。 |
|
|
非离子型对比剂具有低渗透性、低神经毒性等优点,尽量选择非离子型、等渗或次高渗对比剂; 六、剂量选择。 一般情况下,CT增强扫描,碘浓度300~370mg/ml,需用体积0.5~2ml/kg体重。理论上,浓度越高,峰值浓度越高,显示效果越好;浓度偏低,显影效果差一些。对于普通泌尿系统造影没有任何影响,对于CT增强影响颇大。剂量越多,显影效果越好,但是毒性会偏大,过敏及对比剂肾病概率增高,剂量越小,显影浅淡。 我科一般采用370mg/ml,1.5ml/kg来计算,基本上成人60-100ml,基本满足日常需求。 七、流速选择。 含碘对比剂的高压注射速率为1.5~6.0 mL/s。一般推荐为2.5-3ml/s。我科一般采取3ml/s,图像质量尚可。 八、水化 建议在使用碘对比剂前4 小时至使用后24 小时内,对患者给予水化。水化的可能作用机制:增加肾血流量;降低肾素血管紧张素系统的活性;降低对比剂相关的血液粘滞度和渗透性;等渗性生理盐水可扩充血管内容积;用碳酸氢钠可使肾小管内液体碱性化,可降低肾小管损害。动脉内用药者推荐对比剂注射前6-12小时静脉内补充%生理盐水,或5%葡萄糖加154mEq/L碳酸氢钠溶液,不少于100ml/小时;注射对比剂后亦应连续静脉补液,不少于100ml/小时,持续24小时;提倡联合应用静脉补液与口服补液以提高预防对比剂肾病效果。静脉内用药者n口服补液方式:注射对比剂前4-6小时开始,持续到使用对比剂后24小时口服水或生理盐水,使用量100ml/小时;九、碘对比剂重度外渗处理方法:早期使用50%硫酸镁保湿冷敷,24 小时后改硫酸镁保湿热敷;或者用黏多糖软膏等外敷;或者用地塞米松局部湿敷; 十、小结影像诊断技术对于图像质量影响。 患者机体状态好,血管弹性好、无血管系统性疾病,选用碘对比剂浓度高(370mg/ml),剂量足(按足体重计算剂量),流速快(2.5以上,3ml/s最好),采集时间准确,CT机器性能好,图像显影效果超好的。 1、患者机体差,如动脉粥样硬化严重老年人、小孩子,长期卧床、不配合的重症病人、癌栓及侧枝循环开放的肿瘤患者,显影效果一般。正常成人显影效果都好。 2、碘对比剂,一般选择毒性小、浓度高、剂量足,显影一般效果很好。最早我科采用300mg/ml,因为采购原因,始终显影效果奇差,增加剂量、调整流速,都无法解决问题,后来才发现是浓度过低,对于泌尿系统造影一点影响没有,CT增强影响巨大。后来更换后,效果立竿见影。 3、高压注射器,流速控制2.5-3ml/s,一般显影效果都不错,过高的速率,对于患者血管意外是个挑战。速率过低,峰值浓度不够,显影效果一般。 4、CT机器定期保养,性能优良,越高端的机器,采集越快,但是注意精准控制时间,显影效果好。低端的差一点,偶尔会发发脾气,罢罢工,歇一会,效果差一些。 全身CT增强报告书写模式探讨 一、基本原则 【影诊小考】影像病例报告书写规范、风格及模式探讨(2022年第1期) 对于普通单系统病变,之前文章说过报告描述,没有什么要求,随便写。基本包括重点突出型和公式模式型。第一种重点写主要病变,第二种将病变套入模板内。任何一个刚毕业医学生基本都可以。 对于全身CT增强报告,多为肿瘤或特殊筛查,报告风格完全不同。主要遵循“先恶后良、从头到脚、重点突出、段落分明”的基本原则。 先恶后良,主要先写肿瘤、再写良性病变。 从头到脚,包含全身所有部位,既然报告提及,就要看到。 重点突出,第一行文字肯定是恶性病变,然后是良性,最后是生理性。 段落分明,多部位描述病变,对排版布局有较高要求,最起码美观大方,别一行走天下,不知那是哪。 二、CT增强检查技术段 如果采取特殊检查,报告最上面要表明检查技术。如 头部+颈部+胸部+全腹CT平扫并肝脏CT三期增强,患者体重,剂量,层厚mm,间距mm。 三、报告描述书写细节要求 报告描述中,重点或恶性病变,第一行。其次是良性病变,最后全身模板套入,相关疾病正常描写。还要区别很多情况。 1、单纯恶性肿瘤,无转移 第一行恶性肿瘤。余全身模板套入,正常书写报告。 2、恶性肿瘤并引流区域淋巴结转移 第一行恶性肿瘤,第二行区域淋巴结转移,余全身模板套入,正常书写报告。 3、恶性肿瘤、淋巴结转移、直接转移、血运转移 第一行恶性肿瘤,直接转移,第二行血运转移,第三行区域淋巴结转移,余全身模板套入,正常书写报告。 四、小议结论风格 报告结论风格,包括模糊性报告结论、汇总型报告结论、简约型报告结论、选择性报告结论、分类型报告结论。之前已经写过实例了。 1、模糊性报告,主要包括性质待定、可疑恶性、或有间接提示,如不明原因肺不张或胸膜增厚等模糊性结论,主要对一些无法明确或怀疑恶性病变。 2、汇总型报告,一句话包含所有病变,包括主病灶、淋巴结及全身转移,周围组织侵犯。 3、简约型报告,每行一个病变,清晰明了。主病灶第一行。转移第二行。良性病变按顺序描写即可。 4、选择性报告,多考虑两个病变以上,无法做出选择,需要给出提示。 5、最后一种分类型报告结论,特指乳腺(BI-RADS)、前列腺(PI-RADS)、肺结节((LUNG-RADS))、肝脏肿瘤(LI-RADS)的各种分类,主要给出分类标准。 1类:组织未见异常。 2类:良性病变,可排除恶性。 3类:交界性病变,良恶性均可,需要定期随访。 4类:可疑恶性,需要结合病理检查。可分为4A和4B。 5类:明确恶性病变,需要治疗干预。 6类:病理学证实的明确恶性肿瘤。 下一篇关于PETCT肿瘤诊断及鉴别诊断的病例有点难喽。 |
|
|
|
|
|
|
|
|
|
该图片有可能会引起不适 继续查看 |
|
|
|
|
|
|
该图片有可能会引起不适 继续查看 |
|
|
|
|
|
|
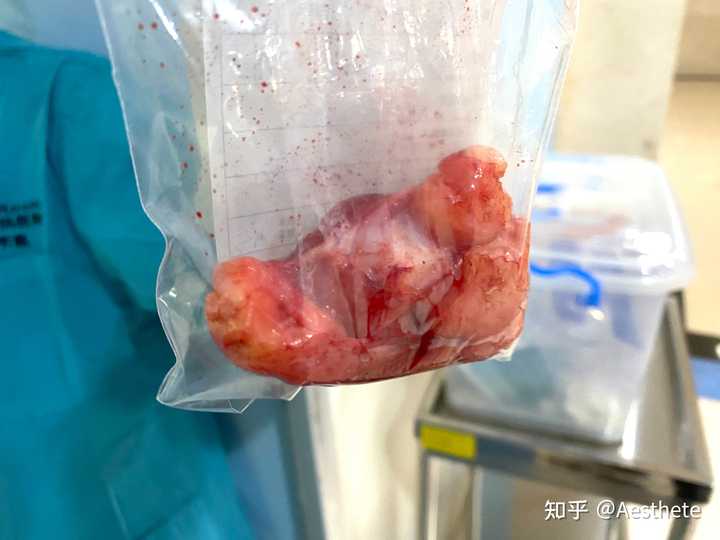
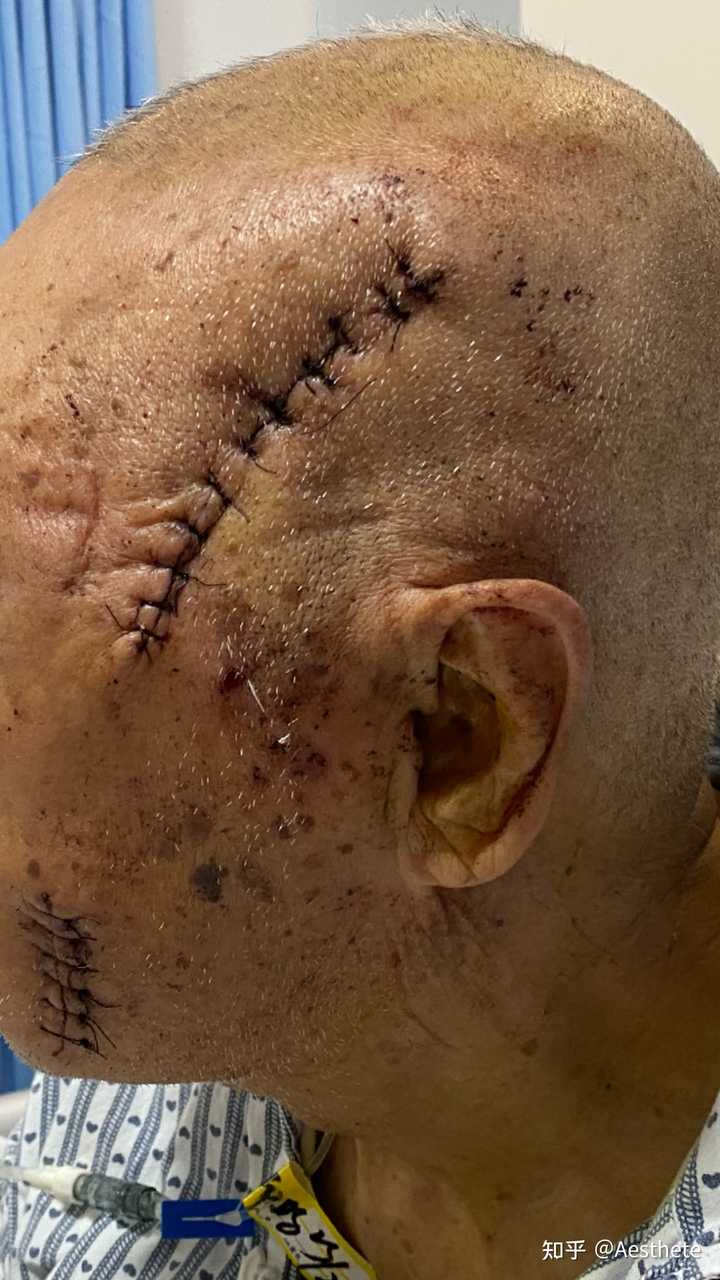
该图片有可能会引起不适 继续查看 89岁,头部皮下脂肪肉瘤,两个加一起快2斤了。 |
|
|
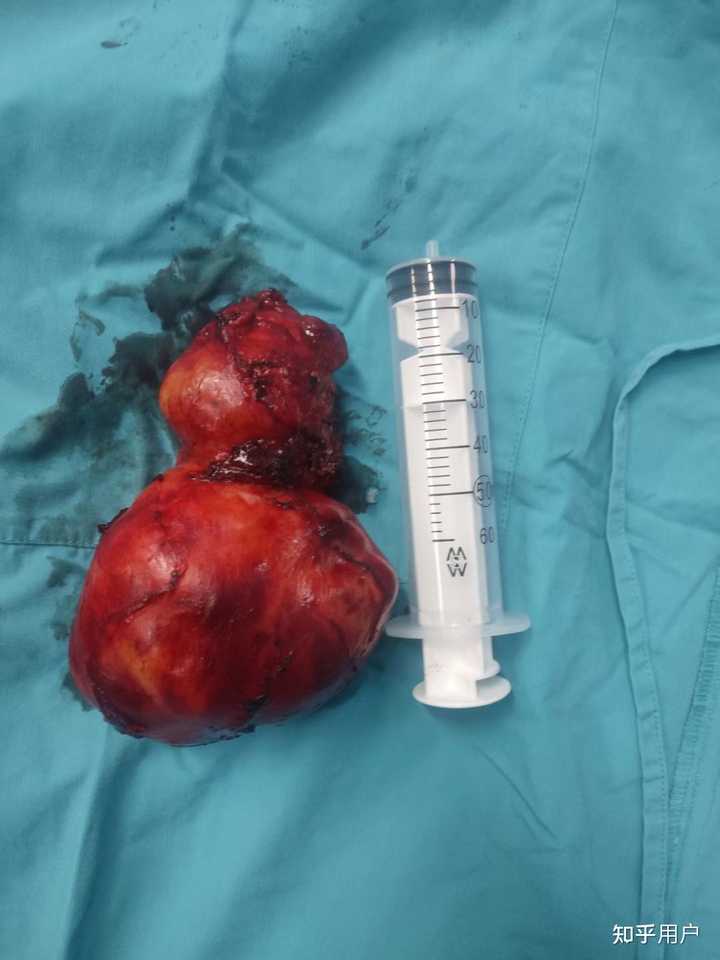
去年切的,畸胎瘤 |
|
|
| [收藏本文] 【下载本文】 |
| 两性话题 最新文章 |
| 如何保持健康的身体? |
| 如果在远洋集装箱货轮上只剩我一个人了能生 |
| 如何看待睡前消息编辑部带货大量含咖啡因产 |
| 为什么现在糖尿病越来越多? |
| 女生在野外如果想尿尿怎么办? |
| 为什么现在年轻人的猝死率这么高? |
| 女生是漂亮重要还是学历重要? |
| 有没有女主一人独美的爽文? |
| 过去的人都吃猪油,现代营养师却禁止,为什 |
| 你经历过的最让你震惊的事情? |
| 上一篇文章 下一篇文章 查看所有文章 |
|
|
|
|
娱乐生活:
电影票房
娱乐圈
娱乐
弱智
火研
中华城市
印度
仙家
六爻
佛门
风水
古钱币交流专用
钓鱼
双色球
航空母舰
网球
乒乓球
中国女排
足球
nba
中超
跑步
象棋
体操
戒色
上海男科
80后
足球: 曼城 利物浦队 托特纳姆热刺 皇家马德里 尤文图斯 罗马 拉齐奥 米兰 里昂 巴黎圣日尔曼 曼联 |
| 网站联系: qq:121756557 email:121756557@qq.com 知识库 |